|
楊非,曹萌,金怡,楊秀山,田沈
首都師范大學生命科學學院,北京 100048
摘要:釀酒酵母Saccharomyces cerevisiae細胞表面展示表達系統是一種固定化表達異源蛋白質的真核展示系統,具有糖基化作用及蛋白翻譯后折疊等優勢,更利于基因工程操作。近年來,酵母細胞表面工程作為一種新興策略來固定化淀粉水解酶、纖維素水解酶以及木聚糖降解酶,從而應用于燃料乙醇的生產。文中著重介紹了酵母細胞表面展示系統的基本原理、研究現狀以及在生物乙醇生產中的應用前景及所面臨的挑戰。
隨著化石能源的日益枯竭,可再生清潔能源生物乙醇的開發和利用受到了人們的廣泛關注。燃料乙醇可以從蔗糖、淀粉和纖維素生物質中獲得,給料的類型決定了發酵過程的復雜程度,方法技術也從簡單的轉化糖發酵發展到利用多種策略來轉化木質纖維素生產乙醇[1]。在本領域的諸多最新研究趨勢中,開發具有同步糖化發酵能力的優良酵母菌株是減少乙醇生產成本的關鍵因素。近年來,隨著生物乙醇的生產由第一代向第二代成功過渡,大量的研究集中在利用酵母細胞表面展示技術來開發能夠轉化多種生物質的生物乙醇生產菌株[2-3]。
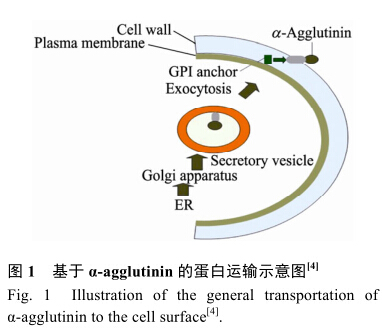
酵母細胞表面展示技術是一種真核蛋白表達系統。其基本原理是將外源靶蛋白基因與特定的載體基因序列融合后導入酵母細胞,融合蛋白誘導表達后,信號肽引導融合蛋白向細胞外分泌,外源蛋白的展示主要是借助于GPI錨的作用,GPI錨定蛋白的C端包含疏水多肽,當細胞蛋白被合成,前體蛋白通過羧基末端的疏水序列錨定在內質網膜上,其余蛋白則位于內質網腔中。在極短的時間內,疏水序列在轉酰氨基酶的作用下ω位點裂開同時被GPI錨置換,并被運輸到高爾基體再通過分泌途徑分泌至細胞膜外。在蛋白水解酶作用下,分泌信號序列被切除,細胞蛋白被磷脂酰肌醇特異性磷脂酶C從細胞膜上釋放并以GPI錨定形式與葡聚糖共價相連被轉運至細胞壁外。圖1展示的是通過α-凝集素系統轉運目的蛋白到細胞表面的分泌途徑。酵母表面展示技術具有表達偏差小,展示的融合蛋白相對分子質量范圍大,分子數量多,篩選、純化、活性測定方便等優點。
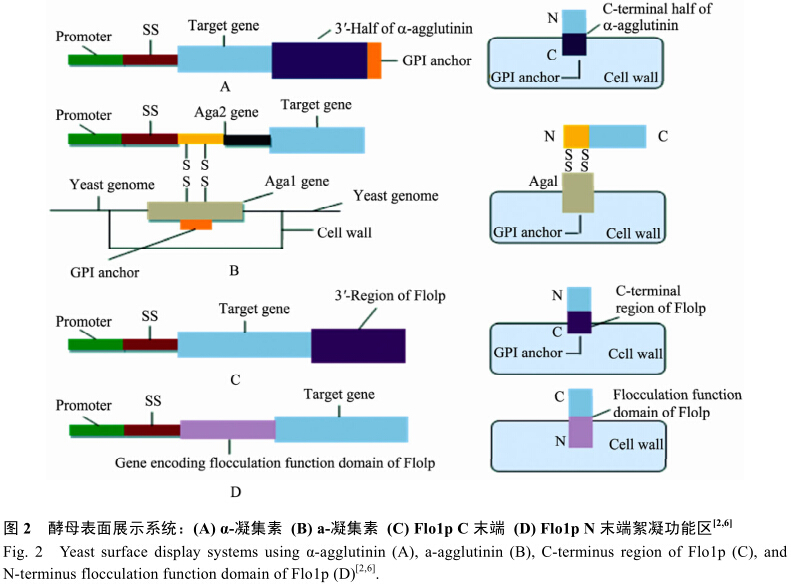
目前,最常見的酵母表面展示系統包括:凝集素展示表達和絮凝素展示表達[5]。如圖2所示,α-凝集素展示表達系統(圖2A)是將外源基因與酵母編碼α-凝集素C端編碼序列連接后插入質粒載體的分泌信號肽(Secretion signal,SS)下游,融合蛋白誘導表達后,信號肽引導嵌合蛋白向細胞外分泌,由于融合蛋白C-末端存在含GPI錨定信號(GPIanchor attachment signal)的凝集素多肽序列,可將蛋白錨定在酵母細胞壁上,從而將蛋白分子展示表達在酵母細胞表面;a-凝集素展示系統(圖2B)與α-凝集素展示系統不同的是其具有由二硫鍵連接的Aga1和Aga2兩個亞基,目的蛋白通過與Aga2形成融合蛋白,再通過Aga1末端的GPI結構使目的蛋白表達于細胞表面;絮凝素展示表達系統利用絮凝素基因(flo1p)與外源基因融合,并將融合蛋白展示表達在細胞表面,此系統又包括兩個子系統:GPI錨定系統(圖2C)和絮凝結構域(Flo1p flocculation functional domain)錨定系統(圖2D)。GPI錨定系統是利用絮凝素Flo1p的C末端含有的GPI結構錨定外源蛋白,此系統與α-凝集素展示相似;絮凝結構域錨定系統是利用Flo1p的中間絮凝功能結構域與外源蛋白融合,通過絮凝功能結構域識別酵母細胞壁中的甘露聚糖鏈并通過非共價作用誘導細胞粘附、聚集成可逆性絮狀物。進而使外源蛋白表達于酵母細胞表面。
近年來,S.cerevisiae細胞表面展示技術迅速發展并在多個領域得到應用,展現出廣闊的發展前景。可通過使外源蛋白固定化于S.cerevisiae細胞表面,從而生產微生物細胞表面蛋白,包括淀粉酶、纖維素酶等在生物乙醇生產中起關鍵作用的酶蛋白,從而使酵母表面展示技術在生物乙醇生產應用中不斷發展與完善,本文著重介紹了近年來酵母細胞表面工程在生物乙醇菌種開發中的應用與研究進展。
1酵母細胞表面技術展示淀粉分解酶
以淀粉類生物質為主要成分的蔗糖和糖蜜可以實現大規模的乙醇生產,然而,以淀粉為原料生產生物乙醇要經歷多步反應而且生產成本偏高。導致成本偏高的原因主要有兩個:一是由于S.cerevisiae不能直接利用淀粉類物質,因此在發酵過程中需要額外添加大量的葡糖淀粉酶(Glucoamylase)和α-淀粉酶(α-Amylase);二是為獲得較高的乙醇產量,首先要將淀粉在140℃~180℃的高溫下進行糊化,而這也就增加了能耗。為此,大量的研究集中嘗試在S.cerevisiae細胞表面展示淀粉分解酶,從而實現以淀粉類物質為底物的大規模乙醇生產,并取得了一定的成果。
利用細胞表面展示技術構建能利用淀粉的全細胞催化劑,可將編碼淀粉酶的外源基因導入酵母細胞內使其能夠分泌淀粉酶[7]。已經構建好的質粒pGA11帶有編碼米根霉Rhizopus oryzae的葡糖淀粉酶基因,轉化子細胞能夠在以1%可溶性淀粉為唯一碳源的培養基中迅速生長并產生乙醇,葡糖淀粉酶活力穩定至少100h,而且所表達的酶,其酶學性質與天然酶相當[8]。
Murai等[9]是研究細胞表面表達淀粉酶工作的先驅,他們創造性地通過在S.cerevisiae細胞表面展示淀粉酶來開發重組釀酒酵母的研究策略,構建了帶有S.cerevisiae MT8-1的GAPDH啟動子及含有信號肽和glucoamylase/α-凝集素融合基因的載體,glucoamylase來自于R.oryzae,能有效切割淀粉α-1,4和α-1,6糖苷鍵。隨后,Kondo[10]等在具絮凝功能特性的酵母細胞表面展示了葡糖淀粉酶,他們的工作表明,展示在細胞表面的葡糖淀粉酶對酵母的正常生長及乙醇產生無任何影響;厭氧發酵150h后乙醇濃度達到20~30g/L。但Kondo等構建的展示葡糖淀粉酶的重組絮凝酵母在發酵300h的情況下還能保持較高的乙醇產率(0.6~0.7g/(L·h))[10],同時,發酵培養基中低濃度的葡萄糖對減少污染也極為有利。展現了在S.cerevisiae細胞表面展示淀粉酶的優越性。
在批式補料發酵過程中,由于缺少溶解酶——α-淀粉酶,單一展示葡糖淀粉酶的酵母菌株在發酵過程中會有不溶性淀粉的積累。為克服這一問題,Shigechi等[11-14]構建了共展示來自R.oryzae的glucoamylase和來自嗜熱脂肪芽胞桿菌Bacillus stearothermophilus的α-amylase基因,并以可溶性淀粉為底物,進行補料批式發酵。結果表明,將淀粉顆粒處理到與酵母細胞大小相近時可極大程度地提高乙醇產率,發酵100h后乙醇濃度達到60g/L,而且共展示葡糖淀粉酶和α-淀粉酶菌株的絮凝能力與只展示葡糖淀粉酶的菌株基本相同,發酵過程中酵母絮凝能力并不發生改變。在后續的研究中,Shigechi等[14]構建了含有葡糖淀粉酶結合結構域(SBD)突變子的酵母展示株系,結果發現,帶有突變子SBD葡萄淀粉酶的菌株較野生型菌株的淀粉降解能力提高1.4倍。
Shigechi等[13]又利用低溫糊化的淀粉(80)℃取代可溶性淀粉作為唯一碳源進行乙醇發酵,結果表明:共展示葡糖淀粉酶和α-淀粉酶的菌株與單展示葡糖淀粉酶的菌株相比,乙醇產率明顯增加,尤其是共展示菌能更快速地產生乙醇且無延滯期,說明隨機水解淀粉α-1,4糖苷鍵的α-淀粉酶在淀粉水解過程中起關鍵作用。比較共展示兩種淀粉酶的菌株在低溫和高溫糊化情況下的發酵效率,無論是最大乙醇濃度、乙醇產率還是底物消耗率,兩種發酵系統都基本相同,乙醇產量為0.5g/g,相當于理論值的97.2%。更好地說明了共展示兩種淀粉酶菌株的優勢。
從牛鏈球菌Streptococcus bovis中分離的淀粉酶為生料淀粉的高效水解提供了新的研究思路[15]。Shigechi等[12]分別以α-凝集素和絮凝素為基礎,共展示來自R.oryzae的葡糖淀粉酶和來自S.bovis148的α-淀粉酶,并以生料淀粉為底物進行發酵試驗,結果表明α-淀粉酶活性依賴于錨定蛋白,而葡糖淀粉酶活性則獨立于錨定蛋白;對于α-淀粉酶活性,以絮凝素系統為基礎構建的菌株要比以凝集素為基礎構建的菌株酶活性高40倍。目前已經報道了一些α-淀粉酶具有結合生料淀粉的能力,且降解淀粉的區域位于C-末端[16]。
以α-凝集素為基礎的共展示菌能以生料淀粉為原料生產乙醇[17-19]。另一方面,基于α-凝集素和絮凝素Flo1p共展示的葡糖淀粉酶和α-淀粉酶在生料發酵過程中不需要額外添加淀粉酶,在發酵過程中,淀粉濃度迅速下降,72h乙醇濃度達到61.8g/L,乙醇產量為0.44g/L,相當于理論值的86.5%。
利用酵母細胞表面展示技術從最初的單展示葡糖淀粉酶到共展示葡糖淀粉酶和α-淀粉酶,均取得了較好的成果,為利用淀粉類物質實現大規模乙醇生產提供了新的思路。不過隨著生物乙醇生產技術的不斷發展,人們開始著眼于利用木質纖維素生產燃料乙醇,從而避免了第一代生物乙醇存在的與人爭糧的缺陷。
2酵母細胞表面技術與第二代生物乙醇
由于第一代生物乙醇的生產存在著與人爭糧、與糧爭地的缺陷,發展第二代生物燃料是人們面對能源、環境與糧食問題所采取的積極措施。利用豐富廉價的可再生木質纖維素生產乙醇,是規模化發展車用燃料乙醇的基礎。木質纖維素是地球上最豐富的可再生資源,占地球總生物量的40%左右,高效、廉價地利用木質纖維素轉化為如燃料乙醇等化工產品,是由石油基向生物基經濟社會過渡的基礎。
為此大量的研究開始轉向展示纖維素分解酶、木糖代謝酶等,從而實現新的突破與嘗試,為實現第二代生物燃料的開發與利用提供了一定的理論依據。
2.1展示纖維素分解酶
在纖維素乙醇生產經歷的糖化步驟形成葡萄糖的過程中,S.cerevisiae不能直接利用纖維素類物質,因此在S.cerevisiae中穩定表達纖維素酶是降低生產成本的有效方法。基于α-凝集素C端構建的pCMC11含有來自棘孢曲霉Aspergillusaculeatus的內切羧甲基纖維素酶CMCase)編碼基因,Murai等[20]通過一系列方法證明了cmcase基因成功地錨定在細胞表面,內切羧甲基纖維素酶活性穩定至少120h。當pCMC11和含有β-bgl1的載體(pBG211)共表達時,可以快速地將纖維低聚糖轉化為葡萄糖,從而顯著地提高了利用纖維素的效率。目前已報道了很多在S.cerevisiae中表達多種纖維素酶基因和能夠糖化可溶性纖維寡糖的重組釀酒酵母[21-22]。
Fujita等同樣基于α-凝集素系統在S.cerevisiae細胞表面展示來自絲狀真菌里氏木霉Trichoderma reesei的內切葡聚糖酶Ⅱ的融合蛋白,酵母菌株能明顯提高對大麥β-葡聚糖的水解能力;隨后,構建了共表達內切葡聚糖酶Ⅱ和來自A.aculeatus的β-葡糖苷酶Ⅰ的酵母株系,這種酵母能在以大麥β-葡聚糖為唯一碳源的培養基上生長,在50h內將β-葡聚糖發酵生成乙醇,乙醇產量為0.48g/g,相當于理論值的93.3%,且發酵培養基中的β-葡聚糖能在酵母細胞表面連續水解為葡萄糖,在胞內酶的作用下,立即被利用,轉變為乙醇。同時,酵母細胞的酶活測定結果和流式細胞計數分析結果表明:共展示菌中內切葡聚糖酶Ⅱ和β-葡糖苷酶Ⅰ分子的數量大于單展示菌中內切葡聚糖酶Ⅱ或β-葡糖苷酶Ⅰ分子數的總和[23]。其后,Fujita研究小組[24]將來自T.reesei的纖維二糖水解酶Ⅱ也增加到展示系統中,從而使酵母細胞真正具有水解無定形纖維素能力,同步糖化發酵生成乙醇,結果顯示共展示內切葡聚糖酶Ⅱ和纖維二糖水解酶Ⅱ的菌株比只展示內切葡聚糖酶Ⅱ的菌株對無定形纖維素的水解能力高,且主要產物是纖維二糖,單展示纖維二糖水解酶Ⅱ的菌株主要產物是少量的纖維二糖,單展示內切葡聚糖酶Ⅱ的菌株主要產物是纖維二糖、纖維三糖,而共展示β-葡糖苷酶Ⅰ和內切葡聚糖酶Ⅱ的菌株無乙醇產生。
在以葡萄糖為碳源的培養基里,雖然在40h內所有無定形纖維素不能被完全利用,但其發酵能力也達到10g/L纖維素可產生3g/L的酒精。即每克碳水化合物可產0.45g/g酒精,相當于理論值的88.5%,可他們并沒有報道在纖維素為唯一碳源的條件下該酵母的發酵能力。Shuhei等[25]以共展示三種纖維素酶的重組酵母(內切葡聚糖酶Ⅱ、纖維二糖水解酶Ⅱ、β-葡糖苷酶Ⅰ)和共展示兩種纖維素酶的菌株(內切葡聚糖酶Ⅱ和纖維二糖水解酶Ⅱ)的發酵效果進行比較,結果表明前者的乙醇產量明顯優于后者。
姚淑敏等[26]也成功地將來自裂殖酵母的β-葡糖苷酶Ⅰ以其活性形式展示在S.cerevisiae細胞表面,誘導表達后的β-葡糖苷酶Ⅰ酶活測定顯示,重組酵母菌株誘導培養12h后有酶活,到48h酶活達到最高,最適作用的pH為7.0,最適作用溫度為45℃。
目前,利用酵母細胞表面技術展示纖維素酶,無論單展示還是共展示,均取得了一定的進展,雖然現階段局限于實驗室階段,但相比較而言,在底物利用上已經取得了一定的突破。
2.2展示木糖代謝途徑關鍵酶
S.cerevisiae是傳統的乙醇發酵生產菌株,由于沒有專一性轉化木糖為木酮糖的酶系,不能很好地利用木糖。其中木糖的跨膜運輸被認為是工程菌利用木糖的障礙之一。S.cerevisiae沒有專一性木糖轉運蛋白,木糖運輸是由非專一性的已糖轉運蛋白完成,而此類蛋白對于木糖的親和力遠低于葡萄糖[27]。目前也有部分研究集中于展示木糖代謝途徑的關鍵酶,以填補S.cerevisiae不能利用木糖的缺陷,更好地利用底物生產燃料乙醇,提高底物利用率。Satoshi Katahira等[28]將來自T.reesei的木聚糖酶和米曲霉Aspergillusoryzae的β-木糖苷酶成功地展示在S.cerevisiae細胞表面,改變了S.cerevisiae的代謝途徑,實現了酵母直接發酵來源于白樺木的木聚糖生產乙醇的工藝。結果表明這兩個酶缺一不可,只有在兩者同時存在的情況下才能將木聚糖轉化為木糖。因為S.cerevisiae不能直接利用木糖生產酒精,所以要向S.cerevisiae導入來自畢赤酵母的木糖還原酶和木糖醇脫氫酶以及S.cerevisiae本身的木酮糖激酶,它們共同作用再將木糖轉化成木酮糖-5磷酸,從而使S.cerevisiae能利用木糖;該重組酵母經62h發酵后產生酒精濃度為7.1g/L,表明每克碳水化合物可產0.30g酒精,是理論值的58%。雖然該重組酵母產酒精能力明顯不足,但該實驗為今后開發利用半纖維素指出了一條出路。
侯進等[29]基于α-凝集素系統,將來源于嗜熱細菌Thermus thermophilus的木糖異構酶基因xylA,插入到S.cerevisiae蔗糖酶信號肽序列與α-凝集素的C端編碼序列之間,形成融合表達框,構建重組質粒pSY-xy222,轉化S.cerevisiaeH158。含重組質粒的菌株H158-SXI木糖異構酶活性測定表明,細胞壁上酶活測定值為1.53U,木糖異構酶在S.cerevisiae細胞壁上得到活性表達。木糖葡萄糖共發酵結果顯示,重組菌株木糖利用率較出發菌株提高了17.8%。陳璐菲等[30]利用S.cerevisiae表面展示系統,將來源于C.tropicalis的木糖還原酶基因xyll嵌入帶有His-Tag的S.cerevisiaea-凝集素展示載體pICAS-His,構建重組質粒pICASHis-Ctxyll,并轉化宿主菌S.cerevisiaeMT8-l,通過流式細胞儀快速檢測和篩選,得到重組菌株MT8-1/pICAS-His-Ctxyll。將重組酵母用于葡萄糖(15g/L)和木糖(5g/L)的混合糖發酵實驗。
結果表明,重組酵母MT8-1/pICAS-His-Ctxyll細胞具有良好的生長和產酶特性,同時能轉化木糖產生木糖醇,將2.5g/L木糖轉化生成2.5g/L木糖醇,轉化率達98.7%。
通過展示木糖代謝途徑關鍵酶的重組釀酒酵母在發酵木糖生產乙醇的過程中,木糖異構酶雖有一定的活性表達,但利用木糖產乙醇的木糖利用率并沒有太大的改善,雖然此部分研究工作依舊面臨著很多的問題與挑戰,但這些工作為解決S.cerevisiae代謝工程菌株的木糖利用問題做出了新的研究與嘗試。
2.3基于展示技術的纖維素乙醇統合加工
為了降低生產成本,可以將纖維素糖化和發酵等幾步反應過程合并在一步反應里完成,即統合生物加工(CBP)。CBP要求某種“超級”微生物具有既能水解纖維素又能利用水解纖維素產生的糖類發酵產酒精,可自然界中沒有哪個已知微生物能滿足CBP這樣的要求。改造現有微生物也就成為唯一的選擇[31]。在S.cerevisiae細胞表面分別表達T.reesei的兩種編碼纖維二糖水解酶:纖維二糖水解酶Ⅰ和纖維二糖水解酶Ⅱ的纖維素結合結構域(CBD)基因,同時也構建了兩個串聯排列的CBDI和CBDⅡ融合基因,在細胞表面表達兩種CBD。表達CBDⅠ和CBDⅡ的兩種酵母展示細胞的CBD具有相似的結合纖維素的能力,而表達CBDⅠ和CBDⅡ融合蛋白的酵母細胞比單表達CBD的酵母細胞具有更強的纖維素結合力。展示酵母細胞的結合率主要依賴于展示在細胞表面的CBD分子多少。有CBD和突變CBD酵母展示細胞可用于分析CBD與纖維素的結合機制。而構建共展示CBD和靶酶的酵母細胞,將可以實現在纖維素濾器上構建連續的或多步酶反應的生物反應器系統。
纖維小體是近年來研究的較熱門的一個話題,根據細胞表面展示技術把纖維小體展示在產酒精微生物表面,在纖維素乙醇的生物轉化中具有重要的價值,纖維小體實際上是一個微型而高效的纖維素降解機器。現在已經有學者提出了通過人工設計并通過工程手段改造天然纖維小體的新思路[32]。Tsai研究小組[33]利用來自厭氧菌的纖維素酶構建了迷你纖維小體并重組到酵母細胞中。他們首先選擇熱纖梭菌Clostridium thermocellum的內切葡聚糖酶和解纖維梭菌Clostridium cellulolyticum的內切葡聚糖酶和外切葡聚糖酶構建迷你纖維小體,這個纖維小體仍有水解纖維素的協調能力。而一旦將C.cellulolyticum的內切葡聚糖酶換成β-葡糖苷酶,就可使新的纖維小體具有了纖維素酶的三大酶組分,其水解纖維素能力不但得到提高而且還能發酵產酒精。在以無定形纖維素(PASC)為唯一碳源的培養基里,該酵母發酵能力為每10g/L的PASC可產生3.5g/L的酒精。即每克碳水化合物可產0.49g酒精,相當于理論值的95%。而同樣是以PASC為唯一碳源,Den Haan研究小組[34]因沒有采用纖維小體形式改造酵母,其效果大打折扣。Den Haan等嘗試將來自T.reesei的egl1和扣囊復膜孢酵母Saccharomycopsis flbuligera的bgl1整合到S.cerevisiae中表達。雖然都檢測到有酶活并能利用PASC發酵生產酒精,但其發酵酒精的濃度只為1g/L。從這兩個小組的實驗結果可以明顯看出纖維小體的優勢。
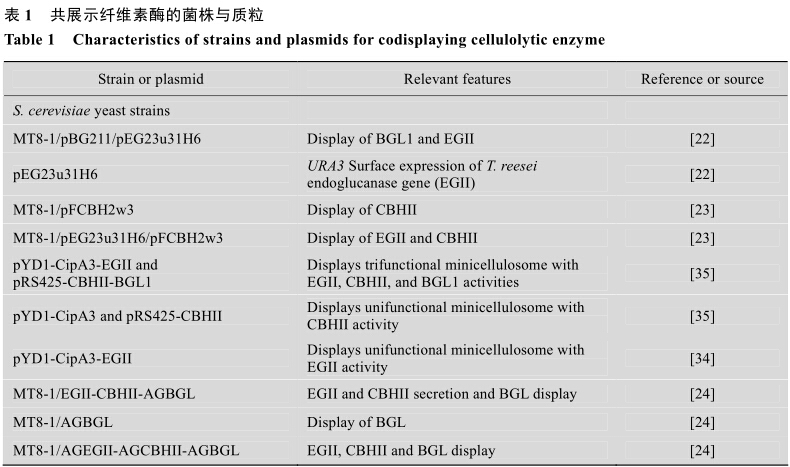
開發應用這種集纖維素水解和發酵于一身的共展示酵母株系,對發酵工業的發展具有重要的意義。這些實驗證明了利用共展示纖維素降解酶的S.cerevisiae發酵生產乙醇的高效性和同步糖化發酵法的可行性。表1中列出了部分研究中已構建的共展示纖維素酶的菌株或質粒。
本實驗室一直致力于纖維素乙醇生產菌種的構建,并且已經成功地構建了基于專利菌株S.cerevisiae Y5的共代謝葡萄糖和木糖的重組釀酒酵母[36]。在以往的研究中,利用野生型工業菌株S.cerevisiae進行纖維素降解酶的展示研究還未見報道。在前期的工作中,本實驗室利用了野生型二倍體工業菌株S.cerevisiae Y5,基于a-凝集素構建了一個能夠有效地接受外源基因,并可以在宿主細胞表面特異性表達的展示系統,并成功展示了來自A.aculeatus的β-葡糖苷酶Ⅰ,該展示菌株能夠在以纖維二糖為唯一碳源的培養基中生長,首次實現了野生型二倍體菌株為宿主的纖維素酶展示。在今后的研究工作中,我們將來自絲狀真菌與纖維素降解有關的酶類展示在酵母表面,并嘗試在野生型二倍體工業菌株中實現多種纖維素酶的展示,以期進一步闡述纖維素的作用機理。實現細胞的自我固定化,并研究以纖維素為唯一碳源的底物利用情況,對比展示前后酶的活性變化,通過消除或減少添加纖維素酶才能完成的糖化步驟,努力實現全細胞催化纖維素乙醇的生物轉化過程,以期大大地降低生物乙醇的生產成本。
3展望
利用S.cerevisiae細胞表面技術展示纖維素降解酶的研究已取得一定的研究成果,該系統已經得到成功開發,但是在這一領域里仍有許多亟待解決的問題,例如:展示在細胞表面的纖維素酶的活性與游離酶相比有所下降;成功展示的纖維素酶穩定性有待提高;對于該技術的研究目前僅停留在實驗室階段,還未實現工業化等。今后,此領域的研究還需更多的發展和完善,包括開發更多的具固定化展示功能的細胞壁甘露糖蛋白;進一步提高現有展示的纖維素酶的穩定性、表達量及活性;建立更多的展示酶篩選技術;克服生產中擴大培養、乙醇抑制等難題。相信隨著分子生物學和生物技術的飛速發展,該領域必將取得更大的進步,以酵母細胞表面展示系統為基礎的纖維素乙醇工業將更大程度地服務于人類社會。
REFERENCES
[1]Sánchez ÓJ, Cardona CA. Trends in biotechnological production of fuel ethanol from different feedstocks.Biores Technol, 2008, 99(13):5270−5295.
[2]Kondo A, Ueda M.Yeast cell-surface display-applications of molecular display.Appl Microbiol Biotechnol, 2004, 64(1):28−40.
[3]Ueda M, Tanaka A.Genetic immobilization of proteins on the yeast cell surface.Biotechnol Adv,2000, 18(2):121−140.
[4]Ueda M, Tanaka A.Cell surface engineering of yeast: construction of arming yeast with biocatalyst.J Biosci Bioeng, 2000, 90(2):125−136.
[5]葉波, 林影, 李雙艷.酵母細胞表面展示系統的研究進展及其應用.工業微生物, 2007, 37(6):53−58.
[6]郭欽, 張偉, 阮暉, 等.釀酒酵母表面展示表達系統及應用.中國生物工程雜志, 2008, 28(12):116–122.
[7]Murai T, Ueda M, Yamamura M, et al.Construction of a starch-utilizing yeast by cell surface engineering.Appl Environ Microbiol, 1997,63(4):1362−1366.
[8]Tubb RS.Amylolytic yeasts for commercial applications. Trends Biotechnol, 1986, 4(4):98−104.
[9]Ueda M, Murai T, Shibasaki Y, et al.Molecular breeding of polysaccharide-utilizing yeast cells by surface engineering.Ann N Y Acad Sci, 1998, 864:528−537.
[10]Kondo A, Shigechi H, Abe M, et al.High-level ethanol production from starch by a flocculent Saccharomyces cerevisiae strain displaying cell-surface glucoamylase. Appl Microbiol Biotechnol, 2002, 58(3):291−296.
[11]Shigechi H, Koh J, Fujita Y, et al.Direct production of ethanol from raw corn starch via fermentation by use of a novel surface-engineered yeast strain codisplaying glucoamylase and α-amylase.Appl Environ Microbiol, 2004, 70(8):5037−5040.
[12]Shigechi H, Uyama K, Fujita Y, et al.Efficient ethanol production from starch through development of novel flocculent yeast strains displaying glucoamylase and co-displaying or secretingα-amylase.J Mol Catal B, 2002, 17(3/5):179−187.
[13]Shigechi H, Fujita Y, Koh J, et al.Energy-saving direct ethanol production from low-temperature-cooked corn starch using a cell-surface engineered yeast strain co-displaying glucoamylase and α-amylase.Biochem Eng J, 2004, 18(2):149−153.
[14]Shiraga S, Kawakami M, Ueda M.Construction of combinatorial library of starch-binding domain of Rhizopus oryzae glucoamylase and screening of clones with enhanced activity by yeast display method.J Mol Catal B:Enzym, 2004, 28(4/6):229−234.
[15]Satoh E, Niimura Y, Uchimura T, et al.Molecular cloning and expression of two-amylase genes from Streptococcus bovis 148 in Escherichia coli.Appl Environ Microbiol, 1993, 59(11):3669−3673.
[16]Lo HF, Lin LL, Chiang WY, et al.Deletion analysis of the C-terminal region of the α-amylase of Bacillus sp.strain TS-23.Arch Microbiol, 2002,178(2):115−123.
[17]Yamada R, Tanaka T, Ogino C, et al.Novel strategy for yeast construction using δ-integration and cell fusion to efficiently produce ethanol from raw starch.Appl Microbiol Biotechnol, 2010,85(5):1491−1498.
[18]Yamakawa SI, Yamada R, Tanaka T, et al.Repeated batch fermentation from raw starch using a maltose transporter and amylase expressing diploid yeast strain.Appl Microbiol Biotechnol,2010, 87(1):109−115.
[19]Yamada R, Bito Y, Adachi T, et al.Efficient production of ethanol from raw starch by a mated diploid Saccharomyces cerevisiae with integrated α-amylase and glucoamylase genes.Enzyme Microb Technol, 2009, 44(5):344−349.
[20]Murai T, Ueda M, Atomi H, et al.Genetic immobilization of cellulase on the cell surface of Saccharomyces cerevisiae. Appl Microbiol Biotechnol, 1997, 48(4):499−503.
[21]Van Rensburg P, Van Zyl WH, Pretorius IS.Engineering yeast for efficient cellulose degradation.Yeast, 1998, 14(1):67−76.
[22]Cho KM, Yoo YJ, Kang HS.δ-integration of endo/exo-glucanase and β-glucosidase genes into the yeast chromosomes for direct conversion of cellulose to ethanol.Enzyme Microb Technol,1999, 25(1/2):23−30.
[23]Fujita Y, Takahashi S, Ueda M, et al.Direct and efficient production of ethanol from cellulosic material with a yeast strain displaying cellulolytic enzymes.Appl Environ Microbiol, 2002, 68(10):5136−5141.
[24]Fujita Y, Ito J, Ueda M, et al.Synergistic saccharification, and direct fermentation to ethanol,of amorphous cellulose by use of an engineered yeast strain codisplaying three types of cellulolytic enzyme.Appl Environ Microbiol, 2004, 70(2):1207−1212.
[25]Shuhei Y, Ryosuke Y, Shohei K, et al.Ethanol production from cellulosic materials using cellulase-expressing yeast.Biotechnol J, 2010,5(5):449−455.
[26]姚淑敏, 倪娜, 徐朝陽, 等.β-葡萄糖苷酶在釀酒酵母表面上的展示及酶學性質的研究.曲阜師范大學學報:自然科學版, 2011, 7(3):81−86.
[27]沈煜, 王穎, 鮑曉明, 等.釀酒酵母木糖發酵酒精途徑工程的研究進展.生物工程學報, 2003,19(5):636−640.
[28]Katahira S, Fujita Y, Mizuike A, et al.Construction of a xylan-fermenting yeast strain through codisplay of xylanolytic enzymes on the surface of xylose-utilizing Saccharomyces cerevisiae cells.Appl Environ Microbiol, 2004, 70(9):5407−5414.
[29]侯進, 沈煜, 鮑曉明.木糖異構酶在釀酒酵母表面表達及對木糖代謝影響的初步研究.生物加工過程, 2006, 4(1):30−34.
[30]陳璐菲, 杜紅麗, 林影, 等.熱帶假絲酵母木糖還原酶在釀酒酵母細胞表面展示.食品與發酵工業, 2008, 34(5):29−34.
[31]黃俊, 陳東, 黃日波.纖維小體在燃料乙醇中的應用.中國生物工程雜志, 2011, 31(1):103−108.
[32]Fierobe HP, Mingardon F, Mechaly A, et al.Action of designer cellulosomes on homogeneous versus complex substrates:controlled incorporation of three distinct enzymes into a defined trifunctional scaffoldin. J Biol Chem, 2005, 280(16):16325−16334.
[33]Tsai SL, Oh J, Singh S, et al.Functional assembly of minicellulosomes on the saccharomyces cerevisiae cell surface for cellulose hydrolysis and ethanol production.Appl Environ Microbiol, 2009,75(19):6087−6093.
[34]Den Haan R, Rose SH, Lynd LR, et al.Hydrolysis and fermentation of amorphous cellulose by recombinant Saccharomyces cerevisiae.Metab Eng, 2007, 9(1):87−94.
[35]Wen F, Sun J, Zhao HM.Yeast surface display of trifunctional minicellulosomes for simultaneous saccharification and fermentation of cellulose to ethanol.Appl Environ Microbiol, 2010, 76(4):1251−1260.
[36]楊態, 張金鑫, 田沈.穩定代謝葡萄糖和木糖產乙醇的重組釀酒酵母工程菌初步構建.應用與環境生物學報, 2009, 15(2):258−261. |
