|
王小波,劉安琪,趙增立,李海濱
(1.中國科學院廣州能源研究所,廣州510640;2.中國科學院可再生能源重點實驗室,廣州510640;3.廣東省新能源和可再生能源研究開發與應用重點實驗室,廣州510640)
摘要:為研究強堿性熔融鹽對生物質氣化粗合成氣中酸性污染氣體的脫除特性,在小型固定床反應器上,采用8.3% Na2CO3-91.7% NaOH對模擬粗合成氣中的H2S進行脫除試驗,并建立了脫除過程的數學模型。結果表明:強堿性熔融鹽對粗合成氣中的H2S有良好的吸收脫除效果,大多數試驗工況下粗合成氣中H2S脫除率均大于99.9%。熔融鹽溫度、表觀氣速等條件對H2S脫除過程影響較小,熔融鹽靜液高度、氣泡大小等對H2S脫除過程有較為明顯的影響。S被熔融鹽吸收以后在熔融鹽內主要以Na2S、Na2SO3、Na2SO4等形式存在,并在熔融鹽內軸向及徑向上基本均勻分布。模型分析表明,在熔融鹽及氣體物性確定的情況下,氣泡大小、熔融鹽靜液高度等操作條件是H2S脫除率的主要影響因素。
引言
生物質能是目前世界上的第四大能源。截止2015年,全世界共有生物質約300億t[1],中國每年可以利用的生物質能源總量約為5億t標準[2],如果全部加以合理利用,可解決目前中國20%左右的能源消費量。生物質主要由碳、氫、氧、氮、硫等元素組成[3]。植物中的硫是植物通過根系從土壤中吸收硫酸鹽,以及通過氣孔從大氣中吸收SO2、H2S等其他形態的硫來滿足自身的生長需要。植物中的S質量分數通常在0.05%~0.29%之間[4]。生物質氣化技術是生物質高效利用的重要及首選方式之一。生物質氣化技術是指限量供應氧化劑,通過熱轉化技術將固態生物質原料轉換成富含H2、CO的合成氣。在氣化過程中,生物質中的S會轉化為以H2S為代表的含S化合物進入到粗合成氣中。因氣化原料及工藝的差別,粗合成氣中H2S的含量差異較大,約為(20~2000)×10-6。采用合成氣制備液體燃料或者化學品的催化合成過程通常要求合成氣中的H2S含量小于1×10-6[5],需要對生物質氣化粗合成氣中的H2S進行凈化脫除。
熔融鹽是指鹽的熔融態液體,通常說的熔融鹽是指無機鹽的熔融體。目前研究較多的高溫熔融鹽為堿金屬(Li、Na、K等)的碳酸鹽、硝酸鹽、氯化物等。由于熔融鹽具有優異的導熱及催化性能,有機物氣化產生的焦油在熔融鹽中被催化裂解[6],同時粗合成氣中的酸性氣體可以原位脫除[7-10],有機物在熔融鹽中直接氣化可以生產高品質合成氣及富氫氣體[6-13]。
將生物質在熔融鹽中直接氣化并原位脫除氣化產生的H2S等酸性雜質氣體,生產高品質合成氣并用于生產液體燃料或化工品是生物質高值化利用的新途徑。有研究者[12]在20世紀80年代開始采用熔融鹽原位吸收廢塑料氣化產生的含S、Cl雜質氣體。在此基礎上Nygard等[13]探討了采用熔融鹽將生物質氣化產生的有害物質(如:H2S、HCl等)原位吸收保留在熔融鹽中的新思路。Kawase等[14]研究了熔融碳酸鹽對粗合成氣中H2S的脫除特性,發現溫度高于900℃時,熔融碳酸鹽對粗合成氣中的H2S有較好的脫除效果,但由于所采用的為弱堿性熔融鹽,吸收效果隨試驗條件變化波動較大,凈化后粗合成氣中H2S含量仍較高,同時文章也未對吸收效果的影響機理進行分析。本文采用試驗研究及模型分析的方法詳細研究了強堿性熔融鹽對生物質中S氣化產生的H2S的吸收脫除過程。
1試驗部分
1.1試驗原料
本文試驗使用的混合熔融鹽組成和熔融溫度見表1,表1中所含無機鹽為純度99.5%以上的分析純Na2CO3以及純度99%以上的分析純NaOH。試驗中所用熔融鹽制備方法如下:1)將無機鹽粉末按表1中的比例混合均勻;2)隨后將混合物放入反應爐中加熱至700℃,保溫30min使混合鹽完全熔融,得到單相均勻混合熔融鹽;3)最后將熔融鹽冷卻備用。
試驗使用的模擬粗合成氣的主要組分為CO3 5.25%、CO2 31.45%、H2 33.30%,同時根據試驗需要混入一定比例的H2S。

1.2試驗裝置及方法
圖1為熔融鹽合成氣成分調整的試驗裝置。試驗裝置主要包括合成氣的進氣及控制裝置、熔融鹽反應裝置、電加熱爐及氣體采樣裝置。熔融鹽反應裝置采用316L不銹鋼。

熔融鹽反應器(φ70mm×400mm)放置于電加熱爐中,電加熱爐溫度采用數值溫控儀控制。試驗前將反應爐內熔融鹽加熱至某一指定反應溫度,以90L/h的流量通入粗合成氣30min以置換反應裝置中的空氣,反應系統產氣穩定后,采集送氣相色譜分析。
含有H2S的粗合成氣從氣體進口進入反應系統,在熔融鹽反應爐內反應吸收,反應后氣體進入采樣系統采樣分析。合成氣中S采樣系統參考相關文獻[16-17]及EPA方法51[18],并略做改動,采用兩級吸收系統:第一級采用0.1mol/L HNO3,第二級采用0.1mol/L NaOH+4%H2O2。
試驗中使用了開孔半徑分別為2.5和5.0mm2種擋板。熔融鹽反應溫度在350~500℃、氣體流速在0.2~1.0L/min(表觀氣速0.87×10-3~4.3×10-3m/s)及熔融鹽液面位置在−70~40mm之間變化時熔融鹽對粗合成氣中H2S吸收效果的影響。
1.3檢測方法
氣體中的硫化氫含量測試方法:含有H2S的氣體進入堿性雙氧水的吸收瓶,S-被氧化成SO42-。將瓶中吸收液取50mL于250mL磨口三角瓶中,在90℃水浴加熱回流12min,敞口蒸發約5min,冷卻后將樣品移入100mL容量瓶中定容,通過0.45μm微孔濾膜進樣分析,測定樣品中S含量。
反應后熔融鹽中S含量測試方法:稱取0.5g左右熔融鹽,將熔融鹽先用去離子水充分溶解,然后添加4%H2O2并定容至100mL。最后采用離子色譜測定溶液中SO42-離子濃度。S濃度Sc為

收集液中的SO42-采用瑞士萬通761-2雙通道型離子色譜儀測定,色譜柱采用Metrosep A supp 4-250通用陰離子分離柱及Metrosep A supp 4/5 Guand陰離子保護柱;洗脫液:1.7mmol/L NaHCO3/1.8mmol/L Na2CO3;洗脫液流量:1.00mL/min;分析溫度和壓力:20.0℃和6.8MPa。儀器SO42-最小檢出限為5×10-9。
2結果與分析
本文研究了熔融鹽反應溫度、氣體流速及熔融鹽液面高度等反應條件對熔融鹽粗合成氣中H2S脫除過程的影響。
2.1吸收條件對H2S吸收效果的影響
2.1.1進口粗合成氣中H2S濃度對H2S吸收率的影響
從圖2可以看出粗合成氣中H2S體積分數在700×10-6~10000×10-6之間變化時,S的吸收率從99.92%增加到99.98%。進口粗合成氣中H2S濃度大于10000×10-6以后,在10000×10-6~40000×10-6之間變化時,吸收率隨濃度的增加略有增加。這是因為根據化學反應動力學,氣泡內H2S濃度的增加能加快氣泡表面熔融鹽中堿性物質吸收反應速率[19],有利于S吸收率的增加。
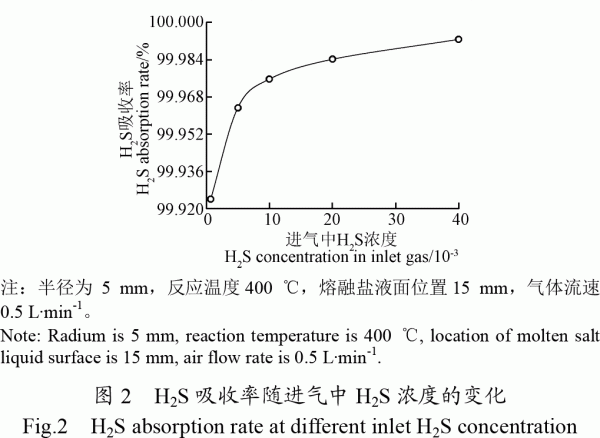
2.1.2熔融鹽液面位置對H2S吸收率的影響
圖3為進氣口擋板直徑不同時,H2S吸收率隨熔融鹽液面位置的變化。試驗條件下,H2S吸收率在熔融鹽液面位置從−70增加到−20mm時,H2S吸收率從99.3%增加到99.9%。熔融鹽液面在−10~40mm之間繼續增加時H2S吸收率略有增加,但變化不是很明顯。熔融鹽液面位置的上升,有利于增加粗合成氣與熔融鹽的接觸時間,從而提高熔融鹽對H2S吸收率。熔融鹽液面位置在−20到40mm變化時,進氣口擋板開孔直徑對H2S吸收率影響較小,不同開孔直徑的試驗結果幾乎重合。熔融鹽液面位置在−70~40mm之間變化時,H2S均保持在較高的吸收率(>99.3%)。這可能是一方面強堿性熔融鹽中的NaOH對酸性H2S具有極好的吸收效果。同時還原性H2S比較不穩定,在熔融鹽的高溫強氧化環境下,容易發生分解反應,分解成H2和S[20]。
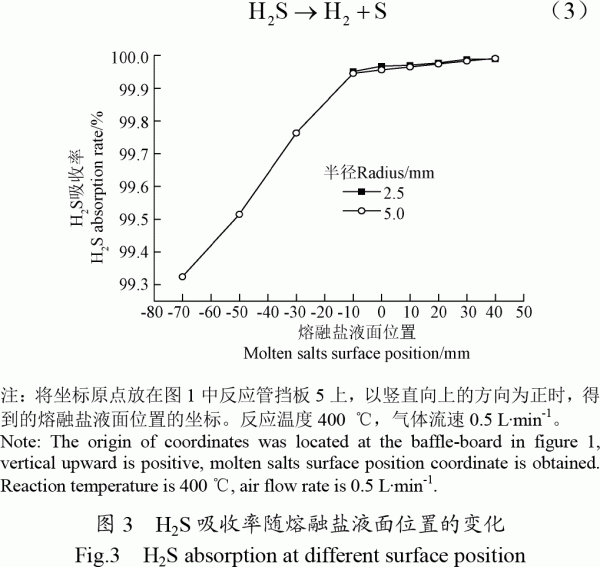
2.1.3氣流速度對H2S吸收率的影響
從圖4可以看出當表觀氣速在0.87×10-3~4.3×10-3m/s之間變化時,H2S吸收率變化不大。H2S吸收率隨氣流速度增加整體呈現減小趨勢。在所有試驗工況下,擋板開孔半徑2.5mm時H2S吸收率均略高于相同工況下擋板開孔半徑5.0mm時的吸收率。在其他試驗條件相同的情況下,氣泡直徑較小時,一方面氣體與液體接觸的總面積會增大;另一方面氣泡內部的H2S傳遞到氣泡表面從而與熔融鹽接觸反應的傳遞路徑會減小。這些都有利于加速H2S從氣體內部傳遞到熔融鹽中的過程,促進熔融鹽對粗合成氣中H2S的吸收,從而提高熔融鹽對H2S的吸收率。氣流速度增加,會使得進入熔融鹽反應爐內的粗合成氣在熔融鹽反應爐內的停留時間減少,從而減少粗合成氣與熔融鹽的反應時間使H2S的吸收率降低。
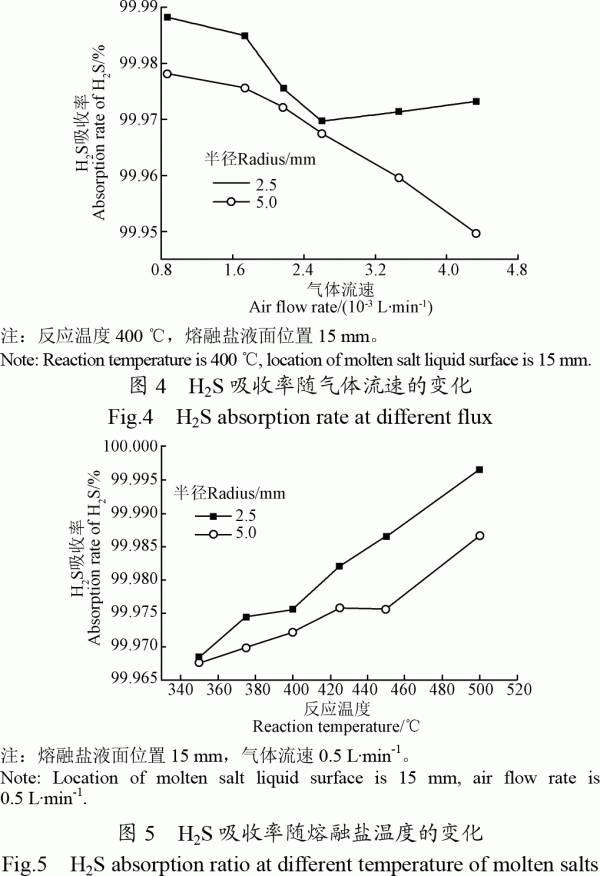
2.1.4熔融鹽溫度對H2S吸收率的影響
圖5為不同進氣口擋板直徑下,H2S吸收率隨反應溫度的變化。隨著反應溫度從350℃增加到500℃,H2S吸收率從99.650%增加到99.995%。H2S脫除效率明顯高于采用熔融碳酸鹽時的脫除效率,同時吸收溫度顯著降低[14]。熔融鹽溫度升高,根據化學反應速率方程,熔融鹽吸收H2S的化學反應速率增加;同時溫度升高H2S從氣泡傳遞到氣泡表面的傳質速率也增加。這些都有利于H2S吸收率的提高。
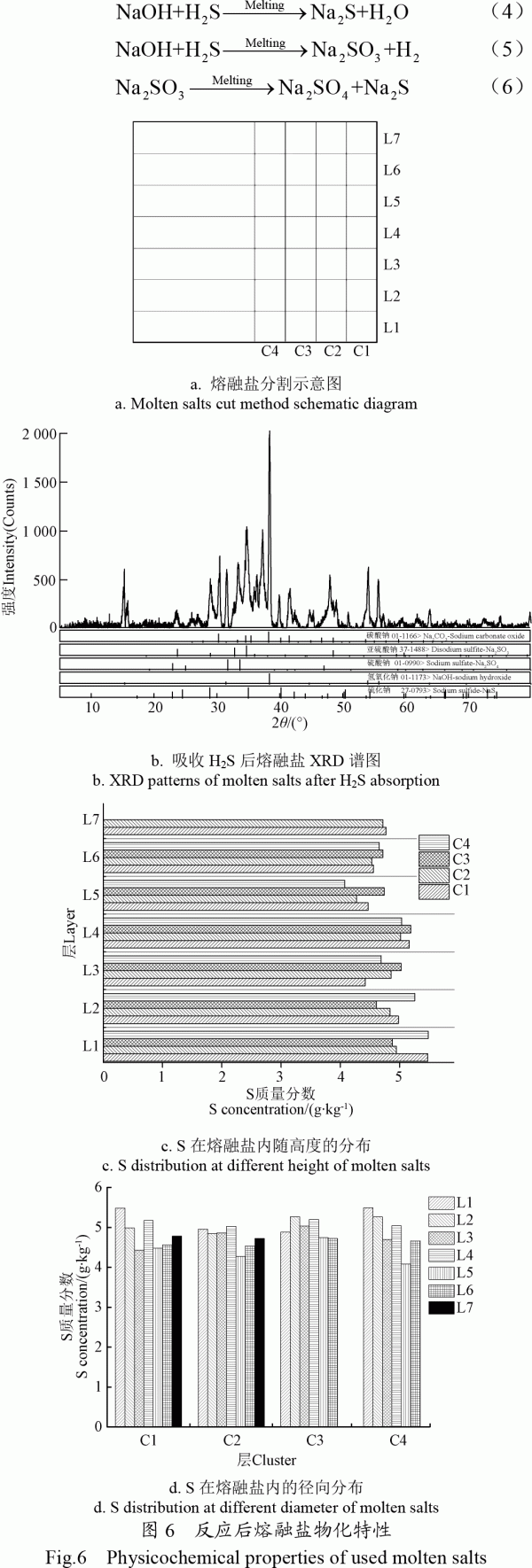
2.2熔融鹽內S分布規律
待熔融鹽冷卻后,將反應吸收一定H2S后的熔融鹽從反應爐內取出,并沿軸向分為7層,徑向分為4層,熔融鹽分割示意圖如圖6a所示。分別測試每一小塊熔融鹽內S含量。反應后熔融鹽的XRD檢測(圖6b)表明,被吸收的H2S在熔融鹽中以Na2S、Na2SO3、Na2SO4等形式存在。如式(4)~式(6)所示,在高溫氧化性NaOH-Na2CO3熔融鹽環境下[21],熔融鹽吸收H2S產生的Na2S被氧化生成更穩定的Na2SO3及Na2SO4。圖6c、d為含S化合物在熔融鹽內沿徑向及軸向的分布。S在軸向上分布總的來說呈現從頂層到底層濃度增加的趨勢。這可能與NaOH、Na2SO3、Na2SO4的密度有關,分別2.14、2.63、2.70g/m3[22]。重力作用下密度稍大的Na2SO4向熔融鹽底部富集,使得熔融鹽底部S濃度增加。同時可以看出S在熔融鹽徑向上分布比較均勻,沒有明顯的變化規律,這可能是由于粗合成氣通入熔融鹽內,對熔融鹽進行了劇烈的攪動使熔融鹽吸收H2S形成的含硫鹽在徑向上均勻分布。
3熔融鹽H2S吸收模型
3.1研究對象及模型假設
為簡化模型建立過程,作如下幾點假設:
1)由于氣泡進入熔融鹽液面內部的距離很小,在本文所有試驗工況下,均小于40mm,熔融鹽液面高度變化引起的氣泡體積變化
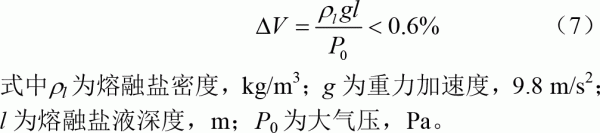
本文中大多數試驗中使用的H2S濃度小于10000×10-6,因H2S被吸收引起的氣泡體積變化小于1%,氣泡直徑變化小于0.35%。因此模型計算中可忽略反應過程中氣泡體積變化,假設反應過程中氣泡體積不變。
2)熔融鹽具有較大的熱容及導熱系數,因此忽略熔融鹽與粗合成氣反應過程中的吸熱/放熱現象所引起的熔融鹽溫度變化,假設反應系統溫度均勻。
3)對單個氣泡而言,氣泡內部的CO2與熔融鹽反應生成Na2CO3引起的熔融鹽內NaOH與Na2CO3質量的變化很小。模型中假設在單個氣泡的反應過程中,熔融鹽成分不變。
3)由于氣泡大小為毫米級,根據格雷斯的研究結論[23],這一尺度的氣泡在運動過程中可維持較為穩定的球狀外形。
3.2 H2S濃度變化模型
在球坐標系下,單位時間內從氣泡內部傳遞到熔融鹽中的氣體的量為[24]


3.3試驗數據擬合
理論上根據式(14)就可以計算給定試驗條件(氣泡直徑、熔融鹽液面位置、熔融鹽溫度等)下H2S的吸收率。但目前對溶液物性的相關研究還不充分,氣體在熔融鹽內的傳質系數、黏度以及熔融鹽中擋板孔徑與氣泡直徑間的關系還缺少詳細的研究數據。
圖7為將試驗數據代入方程(17)得到的處理后的擬合結果。可以看出,按方程處理后的數據基本在同一直線上(半徑為2.5及5.0mm的數據擬合直線R2分別為0.96,0.97),這表明本文建立的模型可以較好的描述強堿性熔融鹽對粗合成氣中H2S的吸收過程。同時該模型原則上也可以用于其他類似化工過程的計算。

4結論
1)強堿性熔融鹽在較低的溫度下就可以高效地脫除粗合成氣中的酸性H2S。優化工況下,強堿性熔融鹽對H2S的吸收率大于99.99%,凈化后合成氣中H2S含量可滿足常規合成工藝要求。吸收后的S以Na2S、Na2SO3、Na2SO4等化合物的形式固定在熔融鹽中。含S化合物在熔融鹽中徑向分布相對較均勻,在軸向上呈現輕微的從頂層到底層濃度增加的趨勢。
2)模型分析表明,凈化后合成氣中H2S濃度與熔融鹽靜液高度、氣泡直徑、物性參數等條件密切相關。在物性參數恒定的情況下,凈化后合成氣中H2S濃度與熔融鹽靜液高度與氣泡直徑的負三次方的乘積呈e指數關系。

 |
