|
穆維娜,李玉成,武超,張學勝,王寧,高兆慧
(安徽大學資源與環境工程學院,安徽合肥230601)
摘要:采用實驗室自制秸稈藍藻混合厭氧反應裝置進行沼氣發酵實驗,利用16S rRNA基因克隆文庫的方法,對不同產氣階段的細菌和古菌的優勢菌群進行多樣性研究。結果表明:①不同產氣階段細菌優勢種類存在差異,供試秸稈沼氣反應器階段細菌種類較為豐富,分屬于6個門:產氣初始階段優勢菌群為變形菌門(Proteobacteria),相對豐度為51.76%;產氣高峰階段優勢菌群為厚壁菌門(Firmicutes),相對豐度為47.13%;產氣結束階段優勢菌群為厚壁菌門(Firmicutes),相對豐度為28.89%;此外,還包括綠彎菌門、螺旋體門、綠菌門的細菌。②古菌種類明顯少于細菌,均屬于甲烷微菌綱(Methanomicrobia)、甲烷桿菌綱(Methanobacteria)和熱原體綱(Thermoplasmata)。秸稈藍藻沼氣系統微生物群落結構的闡明具有一定的意義,可為秸稈沼氣工程調控提供科學依據。
安徽省作為農業大省,每年都有大量的秸稈產生,主要農作物秸稈年理論資源量達4487.99萬t,年可收集資源量達3878.84萬t[1]。秸稈作為農業生產中的副產品是一種容易獲取的生物能源,然而大量的秸稈被隨意丟棄和焚燒,造成了極大的資源浪費和環境污染[2]。巢湖是中國第五大淡水湖,連通長江,巢湖的水質不僅會影響到其周邊環境,還會影響到整個長江流域。巢湖水體近年來富營養化嚴重,藍藻暴發成為環境問題。
藍藻含豐富的有機質,是一種生物質資源[3]。厭氧發酵可以使秸稈和藍藻轉化為清潔能源,既保護了環境也使資源得到了利用[4]。秸稈是一種富含木質纖維素與其他多糖的有機質,而藍藻中含豐富的蛋白質和藻多糖,利用含氮量比較豐富的藍藻調節底物的碳氮比,可以提高發酵的效率[5-6]。彭書傳等利用玉米秸稈和巢湖藍藻進行混合厭氧發酵,與單一的玉米秸稈或藍藻發酵過程相比,玉米秸稈和藍藻混合發酵能夠有效促進沼氣的生成[7]。有機物厭氧降解過程主要分為水解發酵、產氫產乙酸及產甲烷3個階段。其中水解發酵與產氫產乙酸階段主要由細菌參與,涉及一系列復雜的化學代謝過程,生成乙酸等揮發性有機酸;而產甲烷階段主要由甲烷古菌參與,將乙酸轉化為甲烷[8]。沼氣發酵過程需要不同階段的微生物相互協作完成,因此沼氣發酵過程中的微生物群落結構和功能的解析已經成為研究的熱點[9]。目前國內外關于利用秸稈進行發酵的微生物群落研究主要集中在秸稈和禽畜糞便等常規原料的混合上[10],而以秸稈和藍藻混合發酵為對象的研究鮮有報道。分子生物學技術在微生物鑒定方面的應用,可以研究微生物在厭氧發酵過程中變化情況[11-13]。本文在秸稈藍藻混合厭氧產氣的基礎上,通過構建16S rRNA基因克隆文庫,了解混合發酵不同階段的細菌和古菌的優勢菌群及其變化規律,為調控混合發酵過程提供微生物基本信息。結合不同產氣階段的產氣率,解析沼氣發酵各階段優勢微生物的功能,為優化秸稈沼氣發酵工藝提供理論依據。
1材料與方法
1.1材料
1.1.1實驗材料 實驗所用水稻秸稈采自安徽省周邊某稻田,總固體(TS)含量為91.1%,揮發性固體(VS)含量為85.9%,曬干后剪至1cm左右待用;新鮮藍藻采自巢湖塘西河口,總固體(TS)含量為1.96%,揮發性固體(VS)含量為91.58%,經濾網濾水后裝入自封袋置于冰箱冷凍備用,實驗時常溫解凍待用;接種污泥采自實驗室35℃中溫厭氧發酵反應器剩余污泥,TS=3.9%,VS=72.51%,pH=7。
1.1.2實驗裝置 實驗裝置主要由發酵瓶、集氣瓶、集水瓶組成(見圖1)。
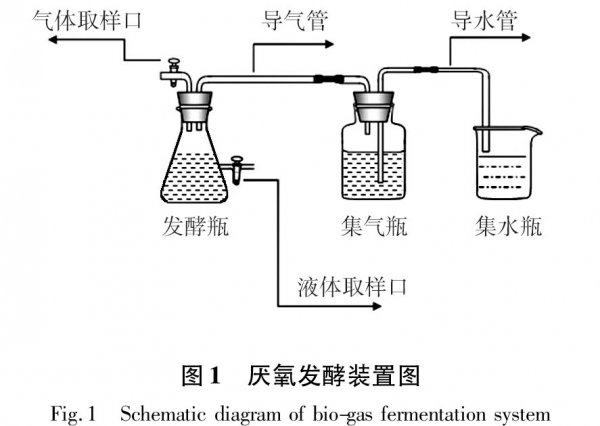
1.2方法
1.2.1發酵與取樣 將處理后秸稈與解凍新鮮藍藻按碳氮比為251混合成發酵原料。將原料分別置于4L厭氧發酵罐中,加入500mL厭氧污泥,配水至2.5L,調節反應總底物的pH至(7.0±0.05)。混勻后裝入反應器內,用氮氣對整個裝置進行吹氮除氧0.5h以上。密封后進行厭氧發酵,發酵溫度35℃,每天保證人為手動振蕩搖晃發酵瓶2~3次,防止顆粒污泥沉淀或秸稈藍藻浮于液面。共采樣3次,分別在第1、7、29天取樣,將樣品依次命名為d1、d7、d29。樣品采集前,先排空采樣管道中殘余的厭氧污泥,然后再將厭氧污泥向外流動幾分鐘后從反應器中取固液混合樣30mL裝入無菌聚丙烯離心管中,凍存于-80℃超低溫冰箱。
1.2.2常規測試方法 TS:105℃烘至恒重;VS:于550℃馬弗爐中燒至恒重;沼氣產量:采用水壓集氣法,每日測量排出的飽和食鹽水總量;甲烷含量:采用安捷倫7890A氣相色譜測定。
1.2.3基因組DNA提取 基因組DNA的提取采用QIAamp DNA Stool mini kit基因組提取試劑盒。為了保證提取樣品的基因組DNA的代表性,每個厭氧污泥樣品平行提取3次,通過1%瓊脂糖凝膠電泳對基因組DNA的提取結果進行檢測。
1.2.4克隆文庫構建 用16S rRNA基因通用引物分別對3個樣品中的細菌和古菌的16S rRNA基因片段進行PCR擴增。其中細菌引物序列為27F(5'-AGAGTTTGATCCTGGCTCAG-3'),1492R(5'-TACGGCTACCTTGTTACGACTT-3');古菌引物序列為AR109F(5'-ACKGCTCAGTAACACGT-3'),AR-912r(5'-CTCCCCCGCCAATTCCTTTA-3')。PCR反應體系與反應條件:預變性94℃預變性4min,94℃變性1min,56℃退火1min,72℃延伸2min(古菌16S rRNA基因延伸時間1min),共35個循環;最后72℃延伸10min;4℃保存。擴增產物進行1%瓊脂糖凝膠電泳,切取目的片段并用膠回收試劑盒(TAKARA,大連)進行純化。純化的PCR擴增產物用pUC-mT載體(生工,上海)依操作說明進行連接,采用熱激法將連接產物轉化至Trans1大腸埃希菌感受態細胞(全式金,北京)中。通過藍白斑篩選陽性克隆對于每個克隆文庫,隨機挑取96個白色克隆子進行PCR鑒定,引物采用M13F/M13R。
1.2.5酶切分型與測序 將鑒定為陽性PCR產物的片段用HhaI和HindIII限制性內切酶消化(37℃),酶切產物用1.5%瓊脂糖凝膠電泳檢測,據酶切電泳圖,將酶切圖譜完全一致的克隆子劃分為1個操作分類單元(operational taxo-nomic unit,OTU)[14],統計各OTU所含陽性克隆的數量,每個酶切分型選取一個代表克隆送至生工生物工程(上海)有限公司進行測序。獲得的16S rRNA基因序列與測定序列在GenBank中進行BLAST同源性檢索,使用MEGA6.06軟件進行系統發育分析。
2結果與分析
2.1秸稈藍藻混合發酵過程曲線
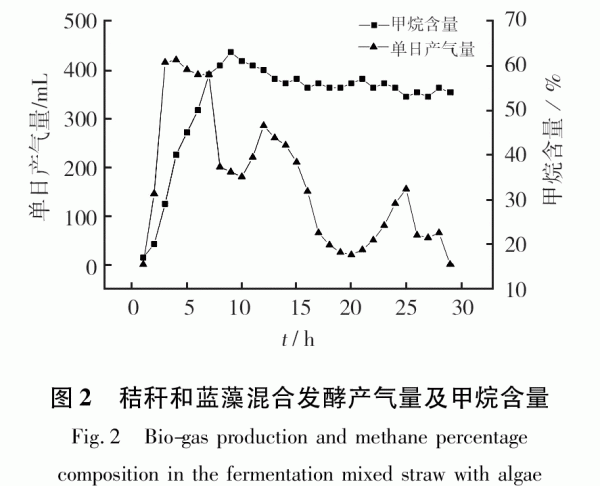
發酵期間日產氣量及每日甲烷含量如圖2所示。反應開始1d快速產氣,7d達到產氣高峰(397mL)。然后隨著原料的減少而逐漸下降,在12d達到第2次產氣高峰(300mL)。甲烷濃度在9d達到63%,隨后小幅回落后上升,并保持50%以上;前12d為單日產氣量較高,12d后進入緩慢增長期;推測在發酵12d后,系統中易產沼氣的物質基本利用完畢,后期主要靠分解難降解物質來產沼氣。29d產氣基本停止。
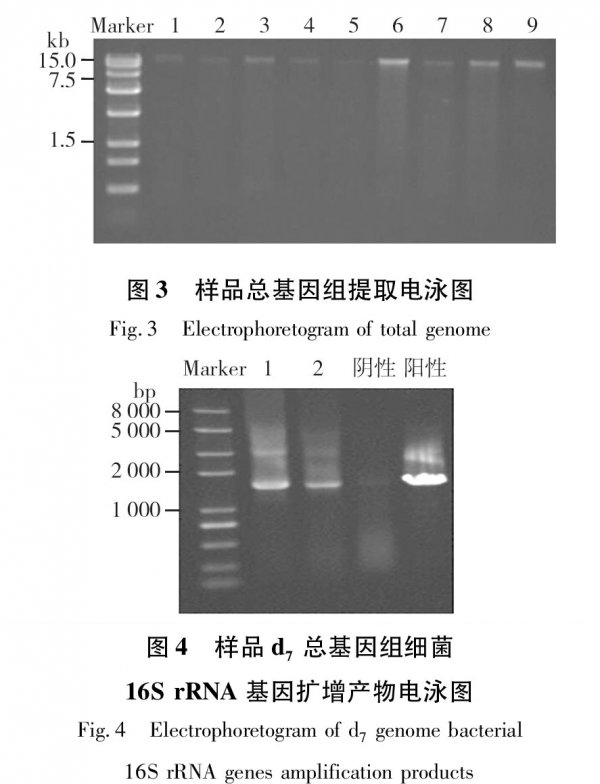
2.2總DNA提取和PCR擴增
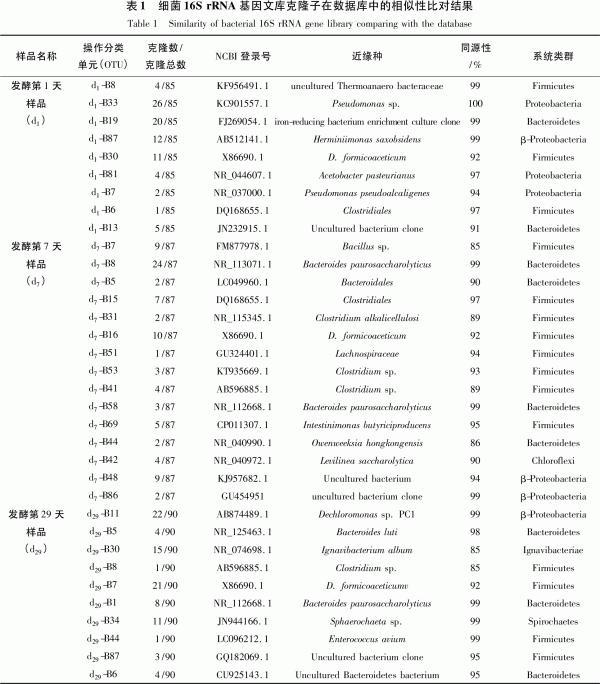
圖3為藍藻秸稈厭氧產氣裝置中樣品總DNA提取電泳圖,所用Marker為全式金的Trans15k,圖中泳道1~3、4~6、7~9依次為樣品d1、d7、d29平行樣。由圖3可知,提取的基因組較完整,大小在20kb左右,可進行下一步的16S rRNA基因片段擴增。圖4為樣品d7總基因組細菌16S rRNA基因PCR擴增電泳圖,所用Marker為全式金的Trans2KPlus,圖中泳道1、2為電泳試驗平行樣。電泳結果表明PCR擴增所產生的DNA片段大小約為1.6kb,說明得到的PCR擴增產物適合下一步的16S rRNA基因克隆文庫的構建。
2.3細菌種群群落分析
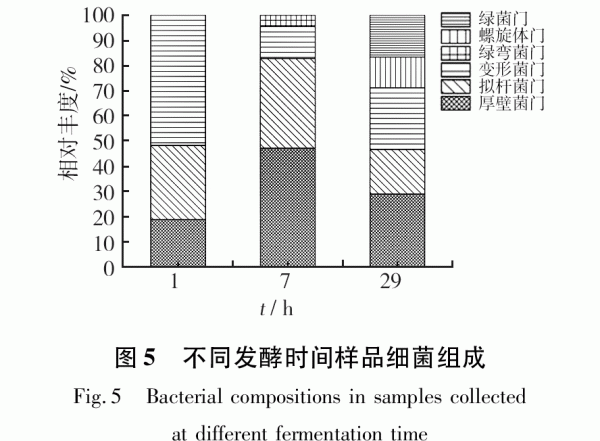
樣品d1 96個克隆子陽性克隆85個,共有9個操作分類單元(OTU);樣品d7 96個克隆子陽性克隆87個,共有15個操作分類單元(OTU);樣品d29 96個克隆子陽性克隆90個,共有10個操作分類單元(OTU)。測得有效克隆子16S rRNA基因序列在GenBank數據庫中進行BLAST比對結果見表1。
由表1可知,隨機挑選的克隆子與GenBank數據庫中已知細菌的序列同源性最高為100%,最低為85%。由比對結果發現,厭氧顆粒污泥中微生物種群豐富,共分6個類群(見表2),分別為厚壁菌門(Firmicutes)、變形菌門(Proteobacte-ria)、擬桿菌門(Bacteroidetes)、綠彎菌門(Chlo-roflexi)、螺旋體門(Spirochaetes)、綠菌門(Ignavi-bacteriae)。其中厚壁菌門、變形菌門與擬桿菌門為主要優勢菌群,分別占3個樣品細菌克隆子總數18.82%~47.13%、12.64%~51.76%、13.33%~35.63%。系統中微生物以變形菌和不可培養細菌為主。
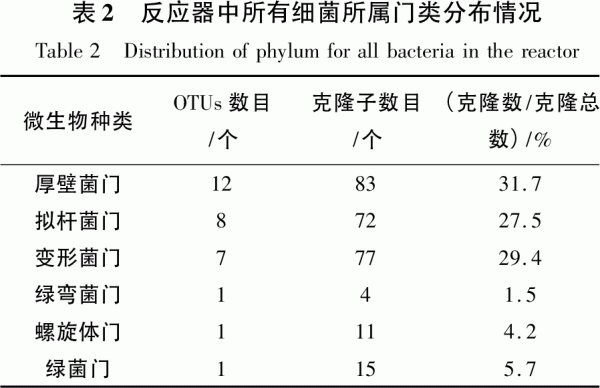
通過分析不同發酵時間樣品細菌群中豐度最大的OTU,可以了解不同發酵時間的重要細菌。3個不同發酵時間細菌群中豐度最大的OTU是不同的(見圖5)。
d1細菌群中豐度最大的OTU為Pseudomonas sp.,屬于變形菌門,占樣品d1總克隆子數的30.6%。Pseudomonas sp.分離自土壤,為短桿狀,革蘭陰性,好氧菌,生長溫度為4~65℃,可利用葡萄糖,不能水解淀粉[15]。d7細菌群中豐度最大的OTU為Bacteroides paurosaccharo-lyticus,屬于擬桿菌門,占樣品d7總克隆子數的27.6%。Bacteroides paurosaccharolyticus分離自稻草殘渣,革蘭陰性,嚴格厭氧菌,生長溫度為10~40℃,最優35℃,可優先利用阿拉伯糖、木糖、葡萄糖等,麥芽糖、糊精、糖原、淀粉和果膠也可利用,代謝產生乙酸、丙酸和琥珀酸[16]。d29細菌群中豐度最大的OTU為Dechloromonas sp.PC1和D.formicoaceticum,D.formicoaceticum屬于厚壁菌門,占樣品d29總克隆子數的23.3%,是一種嚴格厭氧的革蘭陽性細菌,可利用甲酸、乙酸和少量的甲醇[17];Dechloromonas sp.PC1屬于變形菌門,占樣品d29總克隆子數的24.4%,為革蘭陰性短桿菌,微好氧,最適條件為25℃,pH7。
變形菌門是產氣初始階段的優勢菌群。該門菌的純培養主要分離自土壤、糞便、厭氧活性污泥等,可利用淀粉、長鏈脂肪酸及氨基酸等,具有水解作用,部分細菌有脫氮作用[18]。結合發酵裝置中的物料及接種物,推測該菌很可能來自厭氧污泥或藍藻;擬桿菌門是產氣高峰階段的優勢菌群。該門菌主要分離自海底、腸道、厭氧反應器等厭氧環境,有降解大分子碳水化合物產酸的功能[19];厚壁菌門是產氣終止階段的優勢細菌種群,該門細菌已在厭氧消化污泥、廢水處理反應器[20]、玉米秸稈厭氧反應器[21]等環境中被大量發現,主要進行纖維素降解、有機物水解、長鏈脂肪酸降解,生成小分子物質。
2.4古菌種群群落分析
樣品d196個克隆子陽性克隆85個,共有8個操作分類單元(OTU);樣品d796個克隆子陽性克隆有84個,共有6個操作分類單元(OTU);樣品d2996個克隆子陽性克隆80個,共有4個操作分類單元(OTU)。測得有效克隆子16S rRNA基因序列在GenBank數據庫中進行BLAST比對,其微生物所屬古菌類別較為豐富(見表3)。在科和屬分類水平上(見表4),11個古菌OTUs中可分為Methanoregula、甲烷桿菌屬(Methanobacterium)、甲烷微菌屬(Metha-nosphaerula)、甲烷八疊球菌屬(Methanosarci-na)、甲烷鬃菌屬(Methanosaeta)、甲烷繩菌屬(Methanolinea)、馬氏甲烷球菌科(Methanomas-siliicoccus)與甲烷螺菌屬(Methanospirillum)、甲烷桿菌科(Methanobacteriaceae)。其中,Meth-anoregula和甲烷八疊球菌屬為文庫中的優勢克隆,分別占克隆總數的15.1%和13.2%。
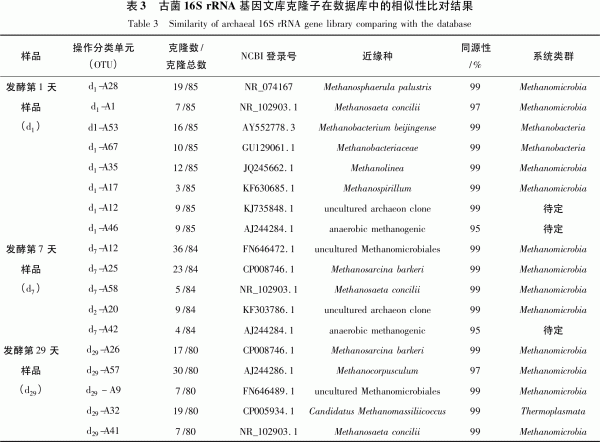
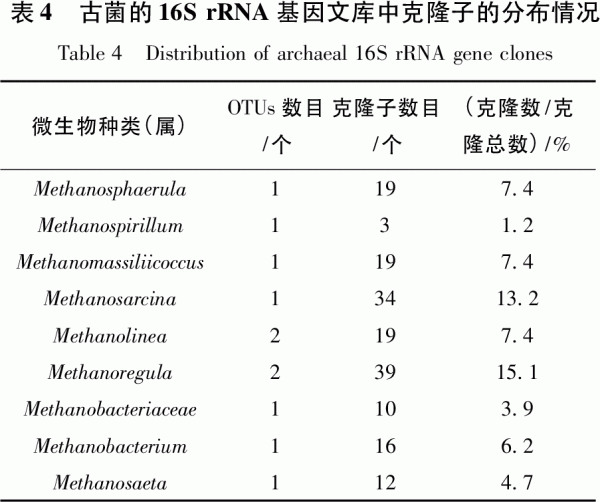
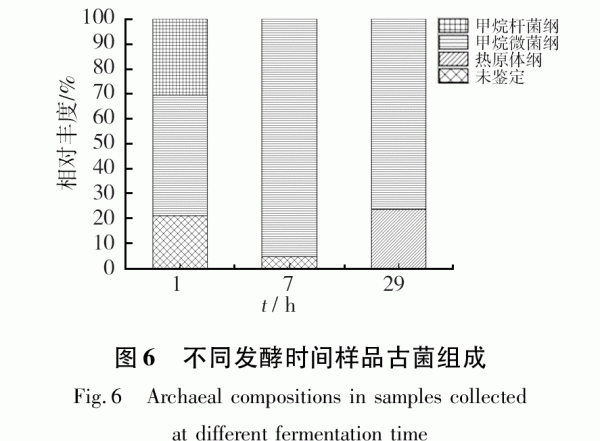
通過分析不同發酵時間樣品古菌群中豐度最大的OTU,可以了解不同發酵時間的重要古菌。各樣品在綱(Class)水平上的組成情況是不同的(見圖6)。甲烷微菌在d1系統中占48.2%,到d7迅速升高至95.2%,d29后又有所下降,但仍占76.3%。甲烷微菌呈短、彎桿,不產芽胞,革蘭陰性,極端嚴格厭氧。最適生長溫度40℃,最適pH6.1~6.9。以H2或甲酸鹽為電子供體還原CO2為CH4,不利用乙酸、甲基胺和甲醇、H2,可在瘤胃液中分離到。甲烷微菌綱含量變化規律與沼氣中的甲烷含量變化規律相似,都是從d1后迅速上升并維持在高位,說明甲烷微菌綱古菌在該混合發酵系統中起主要作用。甲烷桿菌豐度則從d1的30.6%迅速下降到d7的0,隨后d29也未檢測出。甲烷桿菌極端嚴格厭氧,最適生長溫度是37℃,可還原CO2為CH4,不能代謝甲基胺和乙酸,不能固氮,可在水田、沉積物或其他缺氧的環境分離到,推測裝置中甲烷桿菌來自厭氧污泥。熱原體綱在d1和d7未檢測出,而在d29豐度較高,占23.8%。
在屬(Genus)分類水平上,d1古菌群中豐度最大的2個OTU依次屬于甲烷微菌屬(22.3%)、甲烷桿菌(18.8%);d7古菌群中豐度最大的2個OTU為Methanoregula(42.9%)、甲烷八疊球菌屬(27.4%);d29古菌群中豐度最大的2個OTU為甲烷粒菌屬(37.5%)、馬氏甲烷球菌科(23.8%)。
3討論
本研究首先采用實驗室自制秸稈藍藻混合厭氧反應裝置進行沼氣發酵實驗,再分別采集產氣初始期(d1)、產氣高峰期(d7)和產氣終止期(d29)的厭氧發酵液,利用16S rRNA基因克隆文庫的方法,對不同產氣階段的細菌和古菌進行多樣性研究。盡管利用該技術不能反映樣品中所有的微生物類群,但可以反映樣品中主要的優勢細菌、古菌類群。
系統發育分析表明,整個發酵過程中共檢測到6個門類的細菌,即厚壁菌門(31.7%)、擬桿菌門(27.5%)、變形菌門(29.4%)、綠彎菌門(1.5%)、螺旋體門(4.2%)、綠菌門(5.7%)。這與其他秸稈產氣裝置典型類群一致。例如,張蕾等[19]應用16S rRNA基因克隆文庫技術對四種規模化秸稈產氣裝置中微生物的群落分析中發現,厚壁菌門、變形菌門與擬桿菌門為優勢種群。
Yan等[22]發現稻草沼氣系統細菌主要歸屬于擬桿菌門、變形菌門、脫鐵桿菌門(8.9%)和厚壁菌門。Klocke等[23]發現青貯甜菜沼氣系統中優勢細菌主要歸屬于厚壁菌門、變形菌門和擬桿菌門。喬江濤等[9]對玉米秸稈厭氧發酵過程的細菌群落結構進行研究,結果發現厚壁菌門、擬桿菌門、互養菌門及熱袍菌門為優勢菌群。d1細菌群中豐度最大的OTU屬于變形菌門(30.6%),d7細菌群中豐度最大的OTU屬于擬桿菌門(27.6%),d29細菌群中豐度最大的OTU屬于變形菌門(24.4%),這與袁月祥等[21]對玉米秸稈產生物燃氣及其微生物群落解析結果相比發現,產氣初始和高峰優勢菌群一致,而產氣終止的優勢菌群不同,推測是由于物料中添加藍藻,發酵裝置含氮量升高導致變形菌門豐度隨之升高。這些沼氣系統中豐度最大的幾個門基本上都是擬桿菌門、厚壁菌門和變形菌門,但含量有些變化,且不同細菌在發酵過程中的豐度變化趨勢不同。以上結果表明,擬桿菌門和厚壁菌門在富含纖維素的有機廢棄物厭氧發酵過程中發揮著重要作用,需要結合反應器的運行參數與運行狀況,進一步研究這些優勢微生物在沼氣發酵過程中群落演替與代謝功能。
通過構建古菌克隆文庫,得知各樣品所測得的OTU都歸為廣古菌門。分別屬于甲烷微菌綱、甲烷桿菌綱和熱原體綱。其豐度變化與袁月祥等[21]對玉米秸稈產生物燃氣及其微生物群落解析中的古菌含量隨發酵時間變化情況基本吻合。張蕾等[19]在規模化秸稈沼氣發酵反應器中微生物群落特征時,古菌序列均屬于甲烷桿菌綱和甲烷微菌綱。楊承劍等[24]應用16S rRNA基因克隆文庫技術分析廣西富鐘水牛瘤胃產甲烷菌組成及多樣性中發現,所有古菌群落均屬于甲烷桿菌目、熱原體目、除硫球菌目。以上實驗均是只研究了一個時間點,本實驗研究了混合發酵系統中古菌的變化情況。通過比較推測,藍藻的添加對厭氧發酵產沼氣裝置中古菌群落影響不大,不同發酵時間古菌變化趨勢與以秸稈為單一物料產沼氣的趨勢基本相同。不同發酵原料對沼氣系統古菌的多樣性的影響有待進一步研究。

 |
