|
張逸馳,蔣昭泓,劉穎
(西北農林科技大學生命科學學院,楊凌 711100)
摘要:微生物燃料電池是一種利用電化學活性微生物催化降解有機物的同時產生電能的新型產能裝置。陽極電化學活性微生物特征及催化活性是影響微生物燃料電池產電效率的關鍵因素之一。本文對應用于陽極上的電化學活性微生物的富集、來源、菌種的生理生化特征及產電能力等進行了綜述。
1引言
微生物燃料電池(Microbial fuel cell,MFC)可利用污水中的有機物、人類和動物排出的廢物、農作物的廢棄秸桿等發電,具有降解污染物的同時進行產能的雙重功能,作為一種新能源技術已引起中外研究者們的極大興趣[1~5],迄今已有百余年歷史。由于輸出功率較低,尚未實現有意義的大規模實際應用。近年來,MFC的輸出功率已提高3~4個數量級[4,6,7]。在MFC的研究中,對用于陽極的產電微生物研究較為集中,富集在陽極上的電化學活性微生物將有機物氧化用于代謝過程中,產生的電子經過外電路傳遞給陰極,在陰極與電子受體結合,這些氧化還原反應使產生的電子不斷傳遞并在外電路中形成電流[8,9]。
在目前的報道中,MFC陽極中用于產生電流的微生物有幾種名詞,如電化學活性微生物、胞外產電菌及陽極呼吸菌(Electrochemically active bacteria,exoelectrogenic bacteria and anode respiring bac-teria)等。電極表面性質和結構影響細菌的產電機理和產電能力,本文中統稱這類產電的微生物為電化學活性微生物。由于各物質在電極上發生反應時表現出各自不同的電化學活性特征,以及不同產電微生物與電極間表現出電子傳遞特征的差異性[10],目前發現的微生物與電極間電子傳遞主要有納米導線[2]、細胞外膜蛋白[11]及利用微生物自生中介體或外加中介體[12]3種方式,完成微生物與電極間的電子轉移。但常常幾種方式同時作用,如圖1所示。

這類電化學活性微生物在利用電子給體進行氧化的過程中,不同的微生物對于電子給體用于自身細胞物質的合成與用于產電的比率是不相同的;同一種微生物對不同電子給體的作用也是不同的。如有些微生物能將絕大多數電子給體氧化而用于產電,最高比率可達90%以上,有些微生物則將大部分有機物用于同化過程而只氧化少部分電子給體(40%以下),可見電化學活性微生物在電極表面的催化活性是直接與菌種本身對底物利用的特性相關。因此,了解各產電微生物的生理生化特性、篩選優勢的產電微生物及分析不同菌種間的協同作用,對于進一步深入揭示微生物在陽極表面的電子傳遞機制及提高電化學催化能力為加速微生物燃料電池的實際應用具有重要意義。
2電化學活性微生物的來源、富集、分離及鑒定
有關電化學活性微生物在MFC中的研究主要有混合菌及純菌種兩類,純菌種不但底物來源較窄而且操作要求非常嚴格,混合菌除了具有從周圍環境中容易獲得及對環境條件容易適應外,同時在操作上具有相對簡單的特點,尤其是對底物的選擇更加廣泛,所以電化學活性混合菌在實際應用中表現出更加獨特的優勢。從環境中進行電化學活性微生物的富集培養可采用三電極體系的半電池裝置或應用MFC裝置體系,或者直接先篩選鐵還原菌,再從中進一步篩選具有鐵還原性的電化學活性微生物。另一方面,為更清晰地研究電化學活性微生物的具體產電機理,需要對群落中的優勢菌株進行分離純化,分離純化后的菌株可作為理論模型菌利用其降解代謝的具體途徑去探索其內部的產電機理。
2.1電化學活性微生物來源、富集及群落特征
環境中存在著大量電化學活性微生物,廣泛分布在工業廢水包括乳業的糞肥、制作啤酒的廢水、海底沉積物、厭氧活性污泥等自然環境中。目前,已有研究以厭氧顆粒污泥、消化污泥、生活污水以及牛胃液等作為接種源,成功啟動微生物燃料電池,得到的電化學活性微生物群落表現出不同的群落特征及不同的產電能力。對于從不同來源和不同富集條件富集而來的微生物在種類、群落及產電能力上存在著很大差異。乙酸鹽作為厭氧環境中含量最多最簡單的有機酸,是MFC中最常用的底物,在以乙酸鈉為底物富集到的MFC微生物群落中變形菌門(Proteobacteria)占多數,其中大部分為地桿菌屬,地桿菌是陽極電化學活性微生物群落中的主要微生物[13]。另外,以不同有機酸為底物時,MFC的庫倫效率明顯不同,如醋酸鹽、丙酸鹽和丁酸鹽為底物時,庫侖效率分別為72.3%,36.0%和43.0%[14]。
葡萄糖也是MFC中常用底物之一,其中從美國Oyster Bay的厭氧沉積物中富集分離到的R.ferrireducens能直接將葡萄糖氧化為二氧化碳,但對大多數微生物而言,在以葡萄糖作為底物的MFC中,不同微生物降解葡萄糖時會產生不同種類的副產物,副產物對電池的功率密度和庫侖效率也有影響,從而導致陽極上的電化學活性微生物種類也具有多樣性。復雜有機物纖維素在自然界中普遍存在,已有利用瘤胃微生物作陽極生物催化劑與周期性添加纖維素作為底物成功使MFC運行2個多月的先例,其中Clostridium spp.是附著生長的優勢菌,當加入不同的底物時,所富集到的菌種也是不同的[15]。而在Rezaei等[16]設計的U形管MFC,同樣以瘤胃微生物和纖維素分別為催化劑和為底物,分離到的可以利用纖維素產電的微生物是Enterobacter cloacae。同樣,從海底沉積物中及從河水中直接富集到的菌群中也有很大差別[13,17]。可見,所富集的菌群組成特征依賴于菌群的來源及富集環境。
對菌落的分析可采用傳統的Sanger測序技術,但針對該技術檢測通量低和檢測靈敏度不高等問題,已有研究者采用其它聯用技術提高測試性能。例如DGGE方法,具有可靠、可重復、快速等特點,已成為分析微生物群落的多樣性及動態變化的重要工具,為目前分析MFC中微生物群落結構的常用方法[18]。基因文庫分析法也是常用的分子生物學分析技術,進行16SrDNA克隆文庫構建,獲取更為精細的微生物群落結構,進而獲得特定環境中的細菌群落結構和細菌多樣性信息。通過構建16SrDNA克隆文庫,已經取得以厭氧污泥為接種源,并以麥秸為底物而富集的電化學活性微生物群落結構[18]。近來對菌落的群落分析出現了更為先進的高通量測序技術,該方法可以更加準確地對微生物群落進行分析,已逐漸成為目前研究微生物種群最先進的分子生物學技術。該方法已多次用于分析MFC中所利用的電化學活性微生物群落結構特征[19]。
2.2電化學活性微生物菌種的分離與鑒定
對于表現出電化學活性的微生物群落可以進一步進行單一菌種的分離和鑒定工作,目前分離電化學活性微生物主要的應用方法有:稀釋涂布平板法[20]、生物激光印刷法(BioLP)[21]、U形管式的減絕-稀釋培養法(Dilution-to-extinction)[22]等。
分離純菌種的經典的稀釋涂布平板方法可用于從三電極電化學體系或MFC裝置富集到的群落中進行具有電化學活性的純菌種的分離。該方法簡單,易于操作,但由于這種方法很難直接用于從總菌落的稀釋液中尋找產電菌,所以對于分離電化學活性菌有一定的困難。但是若欲分離具有鐵還原能力的產電菌,可采取在培養基中加入檸檬酸鐵,篩選需要Fe(Ⅲ)進行生長的電化學活性微生物,淘汰不具鐵還原能力的菌種,進而提高選擇到具有鐵還原能力的電化學活性菌的機率。
平板劃線分離法與稀釋平板法相比,操作較簡單,但直接應用也存在對產電菌沒有選擇性的問題。減絕-稀釋法的U型管法是最近發現的一種新的分離電化學活性菌的有效方法[23],具體過程是采用一個直型和一個彎曲型玻璃厭氧管分別作陽極和陰極室,將從電極收集的混合菌連續稀釋后,重新接入MFC中,混合菌體在稀釋到一定倍數時,群落中的劣勢電化學活性菌種會被淘汰,從而使其中優勢菌種在電極上得到單一培養,這樣使分離到單一優勢菌成為可能。這種方法避免了傳統分離方法的冗長過程,對得到具有優勢的電化學活性菌簡單有效。該方法是根據菌株的電化學活性能力,而不是還原鐵的能力將不同菌株分離,所以可以克服采用鐵還原篩選法中丟失無還原鐵能力的電化學活性菌的問題[24]。
對于直接分離得到的菌株,可采用16SrDNA方法進行微生物物種鑒定,通過對細菌基因組中的16SrDNA進行克隆測序,最后在Genbank數據庫中進行核酸序列比對及大量的生理生化實驗進行細菌鑒定。近年來,科研者分離出的具有電化學活性和產電功能的微生物種類很廣,包括原核細菌、綠藻及真核酵母菌[25]。但是,總的來說目前已發現的電化學活性菌的種類還很有限,對這些微生物與電極間電子轉移機理的認識還需要做更深入的工作。
3電化學活性微生物的特征及產電能力
目前,從微生物燃料電池中分離出的電化學活性微生物主要以細菌為主,分別為變形菌門、厚壁菌門和酸桿菌門(見表1)。變形菌門是目前研究中發現電化學活性微生物最多的一門,且發現絕大多數產電菌為異化金屬還原菌,并且多數為革蘭氏陰性菌,其中兼性厭氧菌和嚴格厭氧菌偏多。Shewanella和Geobacter是最早研究和研究得較多的兩個屬,常用來作為研究微生物與電極間電子機理的模式菌。
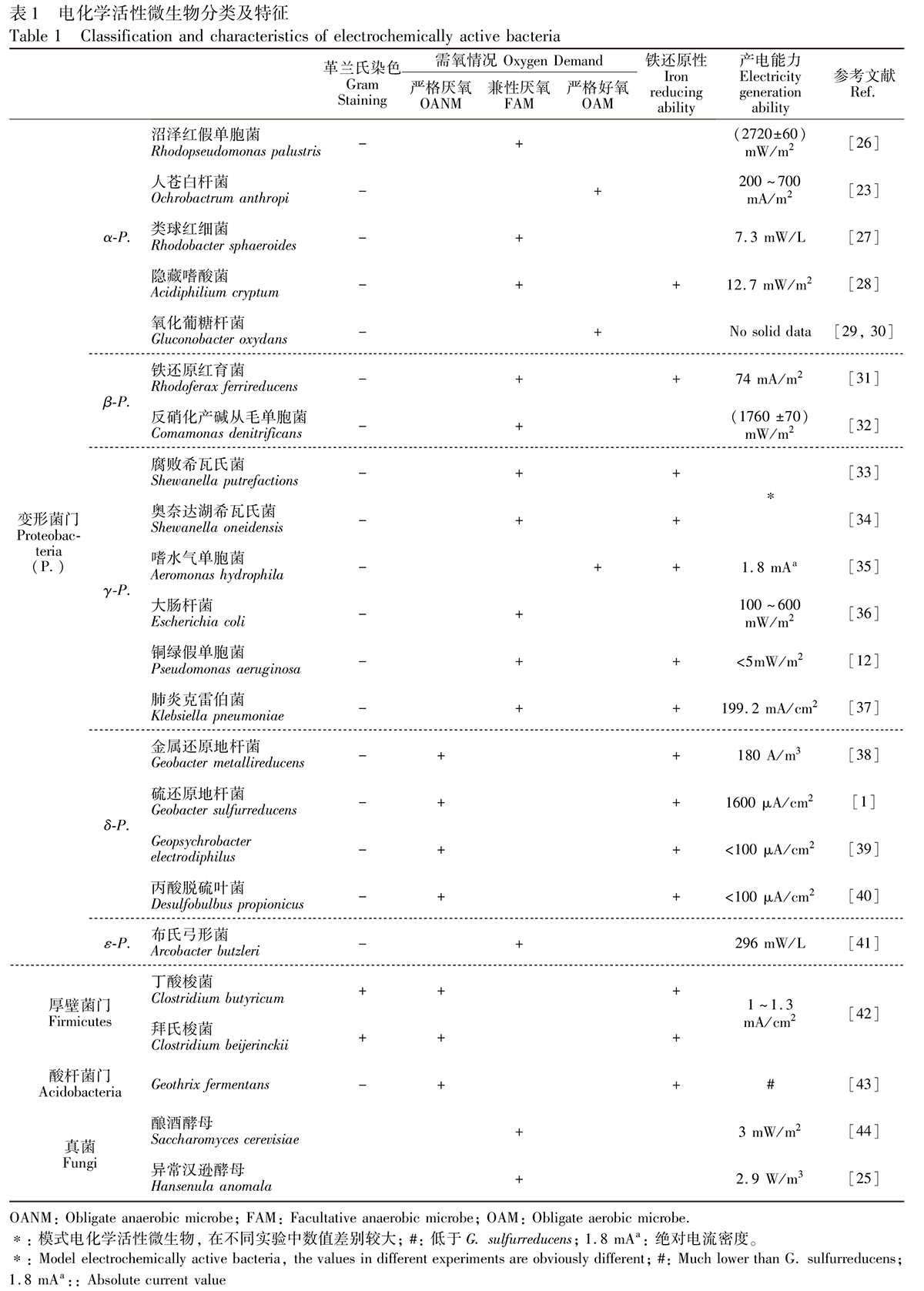
此外,真菌門的酵母菌也發現具有產電能力。第一個發現的不需添加介體的產電的微生物是異化Fe(Ⅲ)還原菌Shewanella putrefaciens[45],屬γ-變形菌綱,但S.putrefaciens不能將底物徹底氧化,而能與電極間直接進行電子轉移的δ-變形菌綱中的G.sulfurreducens可將醋酸鈉徹底氧化為二氧化碳[13]。對Fe(Ⅲ)的還原能力及對氧的耐受性常常是菌種的主要特征,已發現的電化學活性微生物按其對Fe(Ⅲ)的還原能力可分為嚴格厭氧、兼性厭氧及專性好氧的異化鐵還原菌或非異化鐵還原菌5類,下面分別簡述這幾類主要電化學活性菌的生理生化及產電特征。
3.1嚴格厭氧鐵還原菌
鐵元素是地殼中含量第四高的元素,與生物地球化學循環及土壤中許多重要元素轉化密切相關,它對促進土壤物質循環具有重大的環境意義,其中鐵還原微生物在元素的生物地球化學循環中扮演著重要角色。已有報道以固體鐵氧化物為電子受體時細菌的電子轉移過程與以固體電極為電子受體時有相似的機理,盡管目前對這些機理的認識還不是很清楚,但這已為進一步揭示電化學活性微生物與電極間的電子轉移機制有很大幫助。目前發現的嚴格厭氧菌中能還原鐵,且同時能以固體電極為電子受體的菌,主要分布在變形菌門中的δ-變形菌綱、厚壁菌門中的梭菌綱和酸桿菌門中的全噬菌綱中。其中,硫還原地桿菌(Geobacter sulfurreducens)和金屬還原地桿菌Geobacter metallireducens)是目前研究得較多的電化學活性菌種。其所形成的電化學活性微生物膜在底物不存在時通過循環伏安測試可以觀察到兩對明顯的氧化還原峰(相對于Ag/AgCl電極,式電位分別為-376和-295mV),在底物存在時表現出典型“S冶形的對底物的催化特征[1,46]。
3.1.1變形菌門中的δ-變形菌綱
(1)硫還原地桿菌(Geobacter sulfurreducens)屬于Geobacteraceae科,地桿菌屬(Geobacter),為革蘭氏陰性菌,專性厭氧,電子供體較少,僅能以乙酸和氫氣為電子供體,Fe(Ⅲ)、S、Co-EDTA、延胡索酸和蘋果酸為電子受體,多分布于污泥中。G.sulfurreducens是最早報道的厭氧條件下以電極為電子受體完全氧化電子供體的微生物。由于G.sulfurreducens可在電極表面附著生長,細胞間又可形成多層細胞組成的厚度達50μm厚的生物膜,它是研究具有電化學活性微生物膜的模式菌種,通過循環伏安法已證實該微生物膜具有較高的電化學活性(1600μA/cm2)[1]。G.sulfurreducens的全基因組的序列信息已闡明,可作為模式菌研究細胞與電極間電子傳遞機制。
(2)金屬還原地桿菌(Geobacter metallireducens)屬地桿菌科(Geobacteraceae),革蘭氏陰性菌,專性厭氧,能還原鐵、錳及鈾等來降低放射性元素的污染,以氧化鐵為電子受體時能氧化有機酸為二氧化碳及氧化短鏈脂肪酸、乙醇和苯等,具有降低或消除有害污染物毒性的能力,該菌可與電極間直接進行電子交換,產電能力較好(180A/m3)[38]。
(3)Geopsychrobacter electrodiphilus屬于Geobacteraceae科,為革蘭氏陰性菌,在MFC中能徹底氧化乙酸、蘋果酸、延胡索酸和檸檬酸等產電,其具有在低溫海底環境中生長的優勢使它更適合用于發展海水沉積型MFC[39]。(4)丙酸脫硫葉菌(Desulfoblbus propionicus)屬于Desulfobulbaceae科,脫硫球莖菌屬(Desulfoblbus),革蘭氏陰性桿狀菌,但通常用于MFC中產電效率較低(130mA/L)[47]。
3.1.2厚壁菌門中的梭菌綱(有電化學活性的革蘭氏陽性菌)丁酸梭菌(Clostridium butyricum)屬于梭菌屬,菌體梭狀,革蘭氏陽性,嚴格厭氧。C.butyricum EG3是首次報道的能利用淀粉等復雜多糖產電的革蘭氏陽性菌株,革蘭氏陽性菌與電極間的電子傳遞機理是否與革蘭氏陰性菌相同還有待于深入研究[48]。此外,同屬的C.beijerinckii(拜氏梭菌)也可以利用淀粉、糖蜜、葡萄糖和乳酸等產電。
3.1.3酸桿菌門中的全噬菌綱(Holophagae)Geothrix fermentans屬于全噬菌科(Holophagaceae),Geothrix屬,嚴格厭氧,革蘭氏陰性菌。G.fermentans是從石油污染的鐵還原環境中分離出的嚴格厭氧菌,它以電極為唯一電子受體時,能夠徹底氧化乙酸、琥珀酸、蘋果酸、乳酸、丙酸等簡單有機酸,但產電能力較低[43]。
3.2兼性厭氧鐵還原菌
3.2.1變形菌門中的α-變形菌綱隱藏嗜酸菌(Acidiphilium cryptum)屬于Rhodospirillales目、Aceto-bacteraceae科、Acidiphilium屬。 Acidiphilium cryptum是從礦物污水的沉積物中分離出的一株革蘭氏陰性細菌,A.cryptum是首次報道的可以在酸性條件下催化MFC的電化學活性微生物[28],但并不能直接將電子傳遞到電極上,所以在沒有中間介體時無法產電。
3.2.2變形菌門中的β-變形菌綱鐵還原紅育菌(Rhodoferax ferrireducens)屬于叢毛單胞菌科、紅育菌屬,革蘭氏陰性,兼性厭氧。最適生長溫度為25~30℃。在以Fe3+為電子受體時,可以將葡萄糖徹底轉化為CO2獲得能量生長,該菌是最早報道的以電極為電子受體時能直接徹底氧化葡萄糖的電化學活性微生物[31],是發展微生物燃料電池很有潛力的菌種。
3.2.3變形菌門中的γ-變形菌綱
(1)希瓦氏菌(Shewanella)屬于希瓦氏菌科(Shewanellaceae),革蘭氏陰性、兼性厭氧。希瓦氏菌是研究MFC的模式菌屬,該屬可以將產生的電子直接傳遞到陽極。S.putrefactions IR-1是最早分離出來的能直接將電子傳遞給電極的電化學活性微生物,能還原鐵[49,50]。而S.oneidensis DSP10是最早發現的可在有氧條件下產電的菌種,在好氧條件下能將乳酸氧化成CO2并產電,另一菌株S.oneidensisMR-1可以還原Fe(Ⅲ)和Mn(郁)的氧化物,是研究電化學活性微生物與電極間電子傳遞機理時常用的模式電化學活性微生物,已經發現該菌株可以分泌核黃素(Riboflavin),是該菌與電極間電子交換的不可缺少的一種媒介體[49]。
(2)銅綠假單胞菌(Pseudomonas aeruginosa)屬于假單胞菌科(Pseudomona-daceae),革蘭氏陰性桿菌,兼性好氧,P.aeruginosa在產電的同時能夠產生綠膿菌素(Pyocyanin),并作為自身和其他菌種與電極間的電子傳遞介體而提高產電能力,該菌是最早被報道的自身能產生電子介體的微生物[51]。但由于綠膿菌素與其它人為添加的電子介體一樣具有毒性,所以它并不是用于MFC中的理想電化學活性微生物。
(3)肺炎克雷伯菌(Klebisella pneumonia)屬于腸桿菌科Enterobacteriaceae,革蘭氏陰性菌,在厭氧環境下能以電極為電子受體時在陽極上形成的生物膜可直接催化氧化多種有機物而產電,產電性能較好[37]。
3.3好氧異化鐵還原菌的變形菌門中的γ-變形菌綱
Aeromona shydrophilia(嗜水氣單胞菌)屬于Aeromonadaceae科,Aeromonas屬,革蘭氏陰性菌,由于其致病性,不宜用于MFC研究[52]。
3.4兼性厭氧非鐵還原菌
3.4.1變形菌門中的α-變形菌綱
(1)類球紅細菌(Rhodobacter sphaeroides),屬于Rhodobacterales目、Rhodobacteraceae科、Rhodobacter屬,光合細菌,為革蘭氏陰性菌。在好氧黑暗條件下可以利用乙酸、檸檬酸、酒石酸、甘露醇、甲醇和乙醇等;在黑暗厭氧條件下,可以利用丙酮和糖類,但發酵能力微弱,此菌多分布于光照的死水中[53]。該菌用于光合生物燃料電池時在負載高時輸出能量較低[27]。
(2)沼澤紅假單胞菌(Rhodopseudomonas palustris)屬于慢生根瘤菌科(Bradyrhizobiaceae),革蘭氏陰性。該菌最佳的生長方式為光能異養,R.palustris是最早報道具有電化學活性的α-變形菌,它能利用甲酸鹽、丁酸鹽、丙酸鹽、戊酸鹽、乳酸鹽、延胡索酸鹽、乙醇、甘油、酵母膏以及無機物硫代硫酸鹽等多種底物產電,其中利用乙酸鹽產電的功率輸出密度最高[54]。最近,Logan研究組發現R.palustris DX-1菌株除了具有廣泛的產電底物外,還具有更高的產電能力,用該菌催化的MFC最大產電功率輸出遠高于利用混合菌群[26]。
3.4.2變形菌門中的β-變形菌綱Comamonas denitrificans是一種反硝化細菌[55],屬于Burkholderiales科,Comamonas屬,革蘭氏陰性,兼性厭氧。該菌可以利用延胡索酸、丙二酸、丙酮酸、乳酸以及乙酸為電子給體,是目前發現的唯一能產電的反硝化細菌,由于在硝酸鹽存在時,在產電的同時可以產生氮氣,所以可以維持陽極區的厭氧環境。
3.4.3變形菌門中的γ-變形菌綱大腸桿菌(Escherichia coli)屬于腸桿菌科(Enterobacteriaceae),埃希菌屬(Escherichia),革蘭氏陰性菌,兼性厭氧,具有呼吸和發酵兩種代謝類型。一般使用大腸桿菌時需要加入適合的介體如中性紅才能在MFC中產電,有報道其最大輸出功率為100mW/m2[36]。另外,也有報道E.coliK12可利用葡萄糖直接產電,產生的最大功率為600mW/m2[36]。
3.5好氧非鐵還原菌的變形菌門中的α-變形菌綱(α-roteobacteria)
(1)人蒼白桿菌(Ochrobactrum anthropi)屬于布魯菌科(Brucellaceae),蒼白桿菌屬(Ochrobactrum),革蘭氏陰性,專性好氧。O.anthropi能利用廣泛的底物,具有多種代謝途徑,需要注意的是該菌是條件致病菌。O.anthropi YZ-1是Logan研究組首次利用減絕-稀釋的U型管法分離出來的菌株[23]。
(2)氧化葡糖桿菌(Gluconobacter oxydans)屬于醋酸桿菌科(Acetobacteraceae),葡糖桿菌屬(Gluconobacter),革蘭氏陰性菌。該菌是由Lee在2002年首次報道,以電極為其電子受體在介體存在時利用MFC產電的特征來檢測細菌對不同碳源的響應能力,但該菌產電能力較低[57]。
3.6真菌界
近年來,在真菌界也發現一些具有電化學活性的微生物[58]。
3.6.1釀酒酵母(Saccharomyces cerevisiae)釀酒酵母菌屬于真菌界(Fungi)、酵母科(Saccharomyce-taceae),兼性厭氧,可以葡萄糖作為底物及以亞甲基藍作為中間介體進行產電。由于以釀酒酵母制備的MFC具有適用范圍廣和便于機理研究等方面的優勢,該菌目前也成為MFC中的研究熱點[59]。
3.6.2異常漢遜酵母(Hansenul aanmala)該酵母屬于真菌界(Fungi),毛霉科(Mucoraceae),兼性厭氧。H.anmala是最早報道的可以產電的真菌,其產電不需要加入中間介體,可直接將電子傳遞到電極上[60]。該酵母可利用葡萄糖產電,但與其它產電細菌相比,酵母產電能力較低。
3.7影響電化學活性微生物產電能力的主要因素
對于MFC的陽極,分布在細菌和真菌中的電化學活性微生物具有豐富的物種多樣性,目前隨著研究的不斷深入仍在不斷增加,這些已發現的不同菌株表現出明顯不同的產電特性。盡管表1中所列出的不同菌株產生的電流或功率來源于一篇文獻,實際上對于不同工作中的數據不能直接對比,但考慮到每個實驗條件及操作方法,各數值間已表現出普遍性規律,如地桿菌產電能力較高,革蘭氏陽性產電菌株較少,且產電能力也較弱。
與傳統燃料電池相比,目前所有菌株的產電能力仍極低。由于胞內的電子從胞內跨膜傳遞到胞外固體電極的過程中要將有機物在以電極為電子受體時進行氧化同時釋放出電子和質子,釋放出的電子要不斷地由外膜傳遞到電極上進而進入外電路中。其中有些特定的菌株(如地桿菌屬)具有內在獨特的呼吸鏈表出對特定有機物的利用及向細胞外膜的電子傳遞能力較高,從而表現出較好的產電能力。可見,不斷優化菌種并根據這些產電的優勢菌株生產工程菌是提高電化學活性微生物產電能力的內在因素。另外,電極材料的結構和表面性質也是影響微生物產電的重要因素,多孔及石墨烯材料[6]為電子受體時,產電菌已表現出較高的電化學催化性能。
4MFC的應用展望
MFC將生物可降解的物質直接轉化為電能,雖然MFC在電能輸出方面目前尚無競爭優勢,但是在很多方面仍有很好的應用前景。如利用電化學活性微生物構建的MFC或Microbial electrolysis fuel cell(MEC)平臺,已在污水處理、生物修復、制取生物燃料及用于生物傳感器等諸多方面顯示出極大的開發應用前景[61~64]。尤其是利用MFC的電量與底物BOD濃度之間的線性關系,作為生物傳感器可實現污水在線監測,同時克服傳統BOD5方法耗時長、過程繁瑣及不能在線檢測的不足[64],利用優化的電化學活性微生物可進一步提高對污水中BOD監測的靈敏度及縮短響應時間,構建低成本和高性能的MFC型BOD傳感器是發展污水監測的有潛力的方向。另外,MFC在[5]及二氧化碳還原[65]等方面的應用研究也在不斷開發。但目前MFC的成本較高、輸出功率仍不理想,微生物與電極間的電子轉移機理尚不清楚,所以還未真正實現大規模的實際應用。
References
1Liu Y,Kim H,Franklin R,Bond D R.Energ.Environ.Sci.,2010,3(11): 1782-1788
2Reguera G,McCarthy K D,Mehta T,Nicoll J S,Tuominen M T,Lovley D R.Nature,2005,435: 1098-1101
3Pandit S,Khilari S,Roy S,Pradhan D,Das D.Bioresource Technology,2014,166: 451-457
4Park I H,Christy M,Kim P,Nahm K S.Biosensors & Bioelectronics,2014,58: 75-80
5Sabina K,Fayidh M A,Archana G,Sivarajan M,Babuskin S,Babu P A S,Krishnan K R,Sukumar M.Environ.Technol.,2014,35(17): 2194-2203
6Zhang Y Z,Mo G Q,Li X W,Zhang W D,Zhang J Q,Ye J S,Huang X D,Yu C Z.Journal of Power Sources,2011,196(13): 5402-5407
7Ren H,Torres C I,Parameswaran P,Rittmann B E,Chae J.Biosensor.Bioelectron.,2014,61: 587-592
8Schr觟der U.Phys.Chem.Chem.Phys.,2007,9: 2619-2629
9Dolch K,Danzer J,Kabbeck T,Bierer B,Erben J,Forster A H,Maisch J,Nick P,Kerzenmacher S,Gescher J.Biore-
source Technology,2014,157: 284-292
10Lovley D R.Curr.Opin.Biotechnol.,2008,19(6): 564-571
11Liu Y,Bond D R.Chemsuchem.,2012,5: 1047-1053
12Rabaey K,Boon N,Hofte M,Verstraete W.Environ.Sci.Technol.,2005,39(9): 3401-3408
13Bond D R,Holmes D E,Tender L M,Lovley D R.Science,2002,295(5554): 483-485
14Chae K J,Choi M J,Lee J W,Kim K Y,Kim I S.Bioresource Technology,2009,100(14): 3518-3525
15Rismani-Yazdi H,Christy A D,Dehority B A,Morrison M,Yu Z,Tuovinen O H.Biotechnology and Bioengineering,
2007,97(6): 1398-1407
16Rezaei F,Xing D F,Wagner R,Regan J M,Richard T L,Logan B E.Appl.Environ.Microbiol.,2009,75(11):3673-3678
17Tender L M,Reimers C E,Stecher H A,Holmes D E,Bond D R,Lowy D A,Pilobello K,Fertig S J,Lovley D R.Nature Biotechnology,2002,20(8): 821-825
18Zhang Y F,Min B K,Huang L P,Angelidaki I.Appl.Environ.Microbiol.,2009,75(11): 3389-3395
19Toh H,Sharma V K,Oshima K,Kondo S,Hattori M,Ward F B,Free A,Taylor T D.Journal of Bacteriology,2011,193(22): 6411-6412
20Wang A J,Sun D,Ren N Q,Liu C,Liu W Z,Logan B E,Wu W M.Bioresource Technology,2010,101(14):5733-5735
21Ringeisen B R,Lizewski S E,Fitzgerald L A,Biffinger J C,Knight C L,Crookes-Goodson W J,Wu P K.Electroanalysis,
2010,22(7-8): 875-882
22Zuo Y,Xing D F,Regan J M,Logan B E.Appl.Environ.Microbiol.,2008,74(10): 3130-3137
23Pham C A,Jung S J,Phung N T,Lee J,Ghang L S,Kim B H,Yi H,Chun J.FEMS Microbiol.Lett.,2003,223:129-134
24Xing D,Cheng S,Logan B E,Regan J M.Appl.Environ.Microbiol.,2010,85(5): 1575-1587
25Prasad D,Arun S,Murugesan A,Padmanaban S,Satyanarayanan R S,Berchmans S,Yegnaraman V.Biosensors & Bioelectronics,2007,22(11): 2604-2610
26Xing D,Zuo Y,Cheng S,Regan J M,Logan B E.Environ.Sci.Technol.,2008,42(11): 4146-4151
27Rosenbaum M,Schroder U,Scholz F.Environ.Sci.Technol.,2005,39(16): 6328-6333
28Borole A P,O憶Neill H,Tsouris C,Cesar S.Biotechnology Letters,2008,30(8): 1367-1372
29Alferov S V,Tomashevskaya L G,Ponamoreva O N,Bogdanovskaya V A,Reshetilov A N.Russian Journal of Electro-
chemistry,2006,42(4): 403-404
30Reshetilov A,Alferov S,Tomashevskaya L,Ponamoreva O.Electroanalysis,2006,18(19-20): 2030-2034
31Chaudhuri S K,Lovley D R.Nature Biotechnology,2003,21(10): 1229-1232
32Xing D F,Cheng S A,Logan B E,Regan J M.Appl.Environ.Microbiol.,2010,85(5): 1575-1587
33Kim H J,Park H S,Hyun M S,Chang I S,Kim M,Kim B H.Enzyme and Microbial Technology,2002,30(2):145-152
34Biffinger J C,Pietron J,Ray R,Little B,Ringeisen B R.Biosens.Bioelectron.,2007,22: 1672-1679
35Pham C A,Jung S J,Phung N T,Lee J,Chang I S,Kim B H,Yi H,Chun J.FEMS Microbiology Letters,2003,
223(1): 129-134
36Zhang T,Cui C,Chen S,Yang H,Shen P.Electrochem.Commun.,2008,10(2): 293-297
37DENG Li-Fang,LI Fang-Bai,ZHOU Shun-Gui,HUANG De-Yin,NI Jin-Ren.Chinese Science Bulletin,2009,(19):
2983-2987
38Call D F,Logan B E.Biosensors & Bioelectronics,2011,26(11): 4526-4531
39Holmes D E,Nicoll J S,Bond D R,Lovley D R.Appl.Environ.Microbiol.,2004,70(10): 6023-6030
40Holmes D E,Bond D R,Lovley D R.Appl.Environ.Microbiol.,2004,70(2): 1234-1237
41Fedorovich V,Knighton M C,Pagaling E,Ward F B,Free A,Goryanin I.Appl.Environ.Microbiol.,2009,75(23):
7326-7334
42Niessen J,Schroder U,Scholz F.Electrochem.Commun.,2004,6(9): 955-958
43Bond D R,Lovley D R.Appl.Environ.Microbiol.,2005,71(4): 2186-2189
44Sayed E T,Tsujiguchi T,Nakagawa N.Bioelectrochem.,2012,86: 97-101
45Kim B H,Kim H J,Hyun M S,Park D H.J.Microbiol.Biotechnol.,1999,9(2): 127-131
46Liu Y,Harnisch F,Fricke K,Sietmann R,Schroder U.Biosens.Bioelectron.,2008,24(4): 1006-1011
47Niessen J,Schroder U,Harnisch F,Scholz F.Letters in Applied Microbiology,2005,41(3): 286-290
48Ren Z,Steinberg L M,Regan J M.Water Science and Technology,2008,58(3): 617-622
49Marsili E,Baron D B,Shikhare I D,Coursolle D,Gralnick J A,Bond D R.PNAS,2008,105(10): 3968-3973
50Kim H J,Park H S,Hyun M S,Chang I S,Kim M,Kim B H.Enzyme and Microbial Technology,2002,30(2):145-152
51Rabaey K,Boon N,Siciliano S D,Verhaege M,Verstraete W.Appl.Environ.Microbiol.,2004,70(9): 5373-5382
52Pham C A,Jung S J,Phung N T,Lee J,Chang I S,Kim B H,Yi H,Chun J.FEMS Microbiol.Lett.,2003,223(1):129-134
53Gomelsky M,Kaplan S.Journal of Bacteriology,1996,178(7): 1946-1954
54ZHANG Ling-Hua,KUANG Zhe-Shi,CHEN Wei,ZHANG Bao-Ling.Journal of South China Normal University,2001,(4): 37-39
55 Gumaelius L,Magnusson G,Pettersson B,Dalhammar G.International Journal of Systematic and Evolutionary Microbiology,2001,51(3): 999-1006
56Lee S A,Choi Y,Jung S H,Kim S.Bioelectrochem.,2002,57(2): 173-178
57Walker A L,Walker Jr C W.Journal of Power Sources,2006,160(1): 123-129
58YIN Yun,LIU Yi-Sheng,WANG Yi-Fei,LI Wei,ZHENG Xiao-Dong.Chinese Journal of Applied & Environmental Biology,2010,16(3): 412-414
59Prasad D,Arun S,Murugesan M,Padmanaban S,Satyanarayanan R,Berchmans S,Yegnaraman V.Biosensors and Bioelectronics,2007,22(11): 2604-2610
60Touch N,Hibino T,Nagatsu Y,Tachiuchi K.Bioresource Technology,2014,158: 225-230
61Bond D R,Holmes D E,Tender L M,Lovley D R.Science,2002,295(5554): 483-485 |
